Алюминий твердый или мягкий
Алюминий твердый или мягкий
Алюминий
 Алюминий – это пластичный и лёгкий металл белого цвета, покрытый серебристой матовой оксидной плёнкой. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Al (Aluminium) и находится в главной подгруппе III группы, третьего периода, под атомным номером 13. Купить алюминий вы можете на нашем сайте.
Алюминий – это пластичный и лёгкий металл белого цвета, покрытый серебристой матовой оксидной плёнкой. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Al (Aluminium) и находится в главной подгруппе III группы, третьего периода, под атомным номером 13. Купить алюминий вы можете на нашем сайте.
История открытия
В 16 веке знаменитый Парацельс сделал первый шаг к добыче алюминия. Из квасцов он выделил «квасцовую землю», которая содержала оксид неизвестного тогда металла. В 18 веке к этому эксперименту вернулся немецкий химик Андреас Маргграф. Оксид алюминия он назвал «alumina», что на латинском языке означает «вяжущий». На тот момент металл не пользовался популярностью, так как не был найден в чистом виде.
Долгие годы выделить чистый алюминий пытались английские, датские и немецкие учёные. В 1855 году в Париже на Всемирной выставке металл алюминий произвёл фурор. Из него делали только предметы роскоши и ювелирные украшения, так как металл был достаточно дорогим. В конце 19 века появился более современный и дешёвый метод получения алюминия. В 1911 году в Дюрене выпустили первую партию дюралюминия, названного в честь города. В 1919 из этого материала был создан первый самолёт.
Физические свойства
Металл алюминий характеризуется высокой электропроводностью, теплопроводностью, стойкостью к коррозии и морозу, пластичностью. Он хорошо поддаётся штамповке, ковке, волочению, прокатке. Алюминий хорошо сваривается различными видами сварки. Важным свойством является малая плотность около 2,7 г/см³. Температура плавления составляет около 660°С.
Механические, физико-химические и технологические свойства алюминия зависят от наличия и количества примесей, которые ухудшают свойства чистого металла. Основные естественные примеси – это кремний, железо, цинк, титан и медь.
По степени очистки различают алюминий высокой и технической чистоты. Практическое различие заключается в отличии коррозионной устойчивости к некоторым средам. Чем чище металл, тем он дороже. Технический алюминий используется для изготовления сплавов, проката и кабельно-проводниковой продукции. Металл высокой чистоты применяют в специальных целях.
По показателю электропроводности алюминий уступает только золоту, серебру и меди. А сочетание малой плотности и высокой электропроводности позволяет конкурировать в сфере кабельно-проводниковой продукции с медью. Длительный отжиг улучшает электропроводность, а нагартовка ухудшает.
Теплопроводность алюминия повышается с увеличением чистоты металла. Примеси марганца, магния и меди снижают это свойство. По показателю теплопроводности алюминий проигрывает только меди и серебру. Благодаря этому свойству металл применяется в теплообменниках и радиаторах охлаждения.
Алюминий обладает высокой удельной теплоёмкостью и теплотой плавления. Эти показатели значительно больше, чем у большинства металлов. Чем выше степень чистоты алюминия, тем больше он способен отражать свет от поверхности. Металл хорошо полируется и анодируется.
Алюминий имеет большое сродство к кислороду и покрывается на воздухе тонкой прочной плёнкой оксида алюминия. Эта плёнка защищает металл от последующего окисления и обеспечивает его хорошие антикоррозионные свойства. Алюминий обладает стойкостью к атмосферной коррозии, морской и пресной воде, практически не вступает во взаимодействия с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Химические свойства
Алюминий — это достаточно активный амфотерный металл. При обычных условиях прочная оксидная плёнка определяет его стойкость. Если разрушить оксидную плёнку, алюминий выступает как активный металл-восстановитель. В мелкораздробленном состоянии и при высокой температуре металл взаимодействует с кислородом. При нагревании происходят реакции с серой, фосфором, азотом, углеродом, йодом. При обычных условиях металл взаимодействует с хлором и бромом. С водородом реакции не происходит. С металлами алюминий образует сплавы, содержащие интерметаллические соединения – алюминиды.
При условии очищения от оксидной пленки, происходит энергичное взаимодействие с водой. Легко протекают реакции с разбавленными кислотами. Реакции с концентрированной азотной и серной кислотой происходят при нагревании. Алюминий легко реагирует со щелочами. Практическое применение в металлургии нашло свойство восстанавливать металлы из оксидов и солей – реакции алюминотермии.
Получение
Алюминий находится на первом месте среди металлов и на третьем среди всех элементов по распространённости в земной коре. Приблизительно 8% массы земной коры составляет именно этот металл. Алюминий содержится в тканях животных и растений в качестве микроэлемента. В природе он встречается в связанном виде в форме горных пород, минералов. Каменная оболочка земли, находящаяся в основе континентов, формируется именно алюмосиликатами и силикатами.
Алюмосиликаты – это минералы, образовавшиеся в результате вулканических процессов в соответствующих условиях высоких температур. При разрушении алюмосиликатов первичного происхождения (полевые шпаты) сформировались разнообразные вторичные породы с более высоким содержанием алюминия (алуниты, каолины, бокситы, нефелины). В состав вторичных пород алюминий входит в виде гидроокисей или гидросиликатов. Однако не каждая алюминийсодержащая порода может быть сырьём для глинозёма – продукта, из которого при помощи метода электролиза получают алюминий.
Наиболее часто алюминий получают из бокситов. Залежи этого минерала распространены в странах тропического и субтропического пояса. В России также применяются нефелиновые руды, месторождения которых располагаются в Кемеровской области и на Кольском полуострове. При добыче алюминия из нефелинов попутно также получают поташ, кальцинированную соду, цемент и удобрения.
В бокситах содержится 40-60% глинозёма. Также в составе имеются оксид железа, диоксид титана, кремнезём. Для выделения чистого глинозёма используют процесс Байера. В автоклаве руду нагревают с едким натром, охлаждают, отделяют от жидкости «красный шлам» (твёрдый осадок). После осаждают гидроокись алюминия из полученного раствора и прокаливают её для получения чистого глинозёма. Глинозём должен соответствовать высоким стандартам по чистоте и размеру частиц.
Из добытой и обогащённой руды извлекают глинозём (оксид алюминия). Затем методом электролиза глинозём превращают в алюминий. Заключительным этапом является восстановление процессом Холла-Эру. Процесс заключается в следующем: при электролизе раствора глинозёма в расплавленном криолите происходит выделение алюминия. Катодом служит дно электролизной ванны, а анодом – угольные бруски, находящиеся в криолите. Расплавленный алюминий осаждается под раствором криолита с 3-5% глинозёма. Температура процесса поднимается до 950°С, что намного превышает температуру плавления самого алюминия (660°С). Глубокую очистку алюминия проводят зонной плавкой или дистилляцией его через субфторид.
Применение
Алюминий применяется в металлургии в качестве основы для сплавов (дуралюмин, силумин) и легирующего элемента (сплавы на основе меди, железа, магния, никеля). Сплавы алюминия используются в быту, в архитектуре и строительстве, в судостроении и автомобилестроении, а также в космической и авиационной технике. Алюминий применяется при производстве взрывчатых веществ. Анодированный алюминий (покрытый окрашенными плёнками из оксида алюминия) применяют для изготовления бижутерии. Также металл используется в электротехнике.
Рассмотрим, как используют различные изделия из алюминия.
Алюминиевая лента представляет собой тонкую алюминиевую полосу толщиной 0,3-2 мм, шириной 50-1250 мм, которая поставляется в рулонах. Используется лента в пищевой, лёгкой, холодильной промышленности для изготовления охлаждающих элементов и радиаторов.
Круглая алюминиевая проволока применяется для изготовления кабелей и проводов для электротехнических целей, а прямоугольная для обмоточных проводов.
Алюминиевые трубы отличаются долговечностью и стойкостью в условиях сельских и городских промышленных районов. Применяются они в отделочных работах, дорожном строительстве, конструкции автомобилей, самолётов и судов, производстве радиаторов, трубопроводов и бензобаков, монтаже систем отопления, магистральных трубопроводов, газопроводов, водопроводов.
Алюминиевые втулки характеризуются простотой в обработке, монтаже и эксплуатации. Используются они для концевого соединения металлических тросов.
Алюминиевый круг — это сплошной профиль круглого сечения. Используется это изделие для изготовления различных конструкций.
Алюминиевый пруток применяется для изготовления гаек, болтов, валов, крепежных элементов и шпинделей.
Около 3 мг алюминия каждый день поступает в организм человека с продуктами питания. Больше всего металла в овсянке, горохе, пшенице, рисе. Учёными установлено, что он способствует процессам регенерации, стимулирует развитие и рост тканей, оказывает влияние на активность пищеварительных желёз и ферментов.
При использовании алюминиевой посуды в быту необходимо помнить, что хранить и нагревать в ней можно исключительно нейтральные жидкости. Если же в такой посуде готовить, к примеру, кислые щи, то алюминий поступит в еду, и она будет иметь неприятный «металлический» привкус.
Алюминий входит в состав лекарственных препаратов, используемых при заболеваниях почек и желудочно-кишечного тракта.
Алюминий

Кусок чистого алюминия
Алюминий — очень редкий минерал семейства меди-купалита подкласса металлов и интерметаллидов класса самородных элементов. Преимущественно в виде микроскопических выделений сплошного мелкозернистого строения. Может образовывать пластинчатые или чешуйчатые кристаллы до 1 мм., отмечены нитевидные кристаллы длиной до 0,5 мм. при толщине нитей несколько мкм. Лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке.
- Структура
- Свойства
- Запасы и добыча
- Происхождение
- Применение
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
Смотрите так же:
СТРУКТУРА

Кубическая гранецентрированная структура. 4 оранжевых атома
Кристаллическая решетка алюминия — гранецентрированный куб, которая устойчива при температуре от 4°К до точки плавления. В алюминии нет аллотропических превращений, т.е. его строение постоянно. Элементарная ячейка состоит из четырех атомов размером 4,049596×10 -10 м; при 25 °С атомный диаметр (кратчайшее расстояние между атомами в решетке) составляет 2,86×10 -10 м, а атомный объем 9,999×10 -6 м 3 /г-атом.
Примеси в алюминии незначительно влияют на величину параметра решетки. Алюминий обладает большой химической активностью, энергия образования его соединений с кислородом, серой и углеродом весьма велика. В ряду напряжений он находится среди наиболее электроотрицательных элементов, и его нормальный электродный потенциал равен -1,67 В. В обычных условиях, взаимодействуя с кислородом воздуха, алюминий покрыт тонкой (2-10 -5 см), но прочной пленкой оксида алюминия А1203, которая защищает от дальнейшего окисления, что обусловливает его высокую коррозионную стойкость. Однако при наличии в алюминии или окружающей среде Hg, Na, Mg, Ca, Si, Си и некоторых других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
СВОЙСТВА

Самородный алюминий. Поле зрения 5 x 4 мм. Азербайджан, Гобустанский район, Каспийское море, Хере-Зиря или остров Булла
Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью, парамагнетик. Температура плавления 660°C. К достоинствам алюминия и его сплавов следует отнести его малую плотность (2,7 г/см 3 ), сравнительно высокие прочностные характеристики, хорошую тепло- и электропроводность, технологичность, высокую коррозионную стойкость. Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминий химически активен (на воздухе покрывается защитной оксидной пленкой — оксидом алюминия.) надежно предохраняет металл от дальнейшего окисления. Но если порошок алюминия или алюминиевую фольгу сильно нагреть, то металл сгорает ослепительным пламенем, превращаясь в оксид алюминия. Алюминий растворяется даже в разбавленных соляной и серной кислотах, особенно при нагревании. А вот в сильно разбавленной и концентрированной холодной азотной кислоте алюминий не растворяется. При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты — соли, содержащие алюминий в составе аниона.
ЗАПАСЫ И ДОБЫЧА

По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14%.
Современный метод получения, процесс Холла—Эру был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии, и поэтому получил промышленное применение только в XX веке.
ПРОИСХОЖДЕНИЕ

Аллюминий, агрегированный с коркой байерита на поверхности. Узбекистан, Навойская область, Учкудук
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико. Самые распространенные вещества, содержащие рассматриваемый металл: полевые шпаты; бокситы; граниты; кремнезем; алюмосиликаты; базальты и прочие. В небольшом количестве алюминий обязательно входит в состав клеток живых организмов. Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
ПРИМЕНЕНИЕ

Украшение из алюминия
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость. Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем.
Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 г. были подарены весы с чашами из золота и алюминия. Мода на ювелирные изделия из алюминия сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
Алюминий: физические свойства, получение, применение, история
Физические свойства алюминия
Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью. Температура плавления 660°C.
По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов.
К достоинствам алюминия и его сплавов следует отнести его малую плотность (2,7 г/см3), сравнительно высокие прочностные характеристики, хорошую тепло- и электропроводность, технологичность, высокую коррозионную стойкость. Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов.
Алюминий и его сплавы делятся по способу получения на деформируемые, подвергаемые обработке давлением и литейные, используемые в виде фасонного литья; по применению термической обработки — на термически не упрочняемые и термически упрочняемые, а также по системам легирования.
Получение
Впервые алюминий был получен Гансом Эрстедом в 1825 году. Современный метод получения разработали независимо друг от друга американец Чарльз Холл и француз Поль Эру. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием графитовых электродов. Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в XX веке.
Применение
Алюминий широко применяется как конструкционный материал . Основные достоинства алюминия в этом качестве — легкость, податливость штамповке, коррозионная стойкость (на воздухе алюминий мгновенно покрывается прочной пленкой Al2O3, которая препятствует его дальнейшему окислению), высокая теплопроводность, неядовитость его соединений. В частности, эти свойства сделали алюминий чрезвычайно популярным при производстве кухонной посуды, алюминиевой фольги в пищевой промышленности и для упаковки.
Основной недостаток алюминия как конструкционного материала — малая прочность, поэтому его обычно сплавляют с небольшим количеством меди и магния (сплав называется дюралюминий ).
Электропроводность алюминия сравнима с медью, при этом алюминий дешевле. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при изготовлении проводников в чипах. Правда, у алюминия как электротехнического материала есть неприятное свойство — из-за прочной оксидной пленки его тяжело паять.
Благодаря комплексу свойств широко распространен в тепловом оборудовании.
Внедрение алюминиевых сплавов в строительстве уменьшает металлоемкость, повышает долговечность и надежность конструкций при эксплуатации их в экстремальных условиях (низкая температура, землетрясение и т.п.).
Алюминий находит широкое применение в различных видах транспорта. На современном этапе развития авиации алюминиевые сплавы являются основными конструкционными материалами в самолетостроении. Алюминий и сплавы на его основе находят все более широкое применение в судостроении. Из алюминиевых сплавов изготовляют корпусы судов, палубные надстройки, коммуникацию и различного рода судовое оборудование.
Идут исследования по разработке пенистого алюминия как особо прочного и легкого материала.
Драгоценный алюминий
В настоящее время алюминий является одним из самых популярных и нашедших широкое применение металлов. С самого момента открытия в середине XIX века его считали одним из ценнейших благодаря удивительным качествам: белый как серебро, легкий по весу и не подверженный воздействию окружающей среды. Стоимость его была выше цен на золото. Не удивительно, что в первую очередь алюминий нашел свое применение в создании ювелирных изделий и дорогих декоративных элементов.
В 1855 г. на Универсальной выставке в Париже алюминий был самой главной достопримечательностью. Изделия из алюминия располагались в витрине, соседствующей с бриллиантами французской короны. Постепенно зародилась определенная мода на алюминий. Его считали благородным малоизученным металлом, используемым исключительно для создания произведений искусства.
Наиболее часто алюминий использовали ювелиры. При помощи особой обработки поверхности ювелиры добивались наиболее светлого цвета металла, из-за чего его часто приравнивали к серебру. Но в сравнении с серебром, алюминий обладал более мягким блеском, чем обуславливалась еще большая любовь к нему ювелиров.
Так как химические и физические свойства алюминия сначала были слабо изучены, ювелиры сами изобретали новые техники его обработки. Алюминий технически легко обрабатывать, этот мягкий металл позволяет создавать отпечатки любых узоров, наносить рисунки и создавать желаемой формы изделия. Алюминий покрывался золотом, полировался и доводился до матовых оттенков.
Но со временем алюминий стал падать цене. Если в 1854-1856 годах стоимость одного килограмма алюминия составляла 3 тысячи старых франков, то в середине 1860-х годов за килограмм этого металла давали уже около ста старых франков. Впоследствии из-за низкой стоимости алюминий вышел из моды.
В настоящее время самые первые алюминиевые изделия представляют большую редкость. Большинство из них не пережило обесценивания металла и было заменено серебром, золотом и другими драгоценными металлами и сплавами. В последнее время вновь наблюдается повышенный интерес к алюминию у специалистов. Этот металл стал темой отдельной выставки , организованной в 2000 году Музеем Карнеги в Питсбурге. Во Франции расположен Институт истории алюминия , который в частности занимается исследованием первых ювелирных изделий из этого металла.
В Советском союзе из алюминия делали общепитовские приборы, чайники и т.д. И не только. Первый советский спутник был выполнен из алюминиевого сплава. Другой потребитель алюминия — электротехническая промышленность: из него делаются провода высоковольтных линий передач, обмотки моторов и трансформаторов, кабели, цоколи ламп, конденсаторы и многие другие изделия. Кроме того, порошок алюминия применяют во взрывчатых веществах и твердом топливе для ракет, используя его свойство быстро воспламеняться: если бы алюминий не покрывался тончайшей оксидной пленкой, то мог бы вспыхивать на воздухе.
Последнее изобретение — пеноалюминий, т.н. «металлический поролон», которому предсказывают большое будущее.
Другие статьи по сходной тематике
Основные понятия о токарной обработке и токарных станках.
Стали марок AISI 409, 430, 439 — аналоги отечественных марок 08×13, 12×17 и 08×17Т
Гидравлические гильотинные ножницы, гильотинные ножницы с ЧПУ для раскроя и обработки листовых материалов.
Правила нанесения обозначений шероховатости поверхностей на чертежах
Как отличить нержавеющую сталь от алюминия?

- Сравнение характеристик
- Способы отличия
- Что лучше выбрать?
По сравнению с нержавеющей сталью алюминий обладает наименьшим – до трёх раз – весом. Сталь и алюминий способны дополнить друг друга, но никак не заменить полностью.


Сравнение характеристик
Алюминий как цветмет дороже стали в несколько раз. Сталь является чернометаллическим сплавом, в котором присутствует лишь незначительное количество цветмета – возможно, в десятых долях процента. Наличие на рынке стальных изделий большого количества – десятки сортов и марок стали – обязано в том числе и вариациям сочетаний черно- и цветнометаллических присадок. Характеристики стали и алюминия в отдельности весьма различны.
Сталь гораздо более прочна, чем алюминий. Но прочность и надёжность редко связаны с низкой плотностью. Главная причина построения летательных аппаратов из алюминиевых сплавов состоит как раз в этом – поднять тяжёлую стальную машину в воздух оказалось бы почти невозможно.


- Нержавейка включает в себя хром – элемент, защищающей её от существенного окисления. Дело в том, что из-за рыхлости окисной плёнки сталь, поскольку она сделана в основном из железа, проржавела бы насквозь. Окисная плёнка на алюминиевых изделиях плотная, кислород из воздуха не проникает сквозь неё, а в бытовых условиях стереть её можно лишь при помощи соды, мыла или наждачки.

Попав в кислую, щелочную или солевую среду, особенно при высокой температуре, алюминий может подвергаться ускоренному окислению, что быстро приводит к его разрушению.
- Алюминий проводит тепло лучше и быстрее, чем нержавейка.

- Алюминий дороже простой стали, но дешевле нержавейки.

- Мягкость алюминиевых сплавов показывает свои слабые стороны уже при 200 градусах. Если бросить в костёр старую алюминиевую сковороду, то она расплавится, не раскалившись докрасна. Чугунная сковорода или нержавеющая вилка либо ложка раскалится до ярко-красного оттенка, но устоит. Впрочем, перегрев нержавейки может перевести сталь в другое состояние, при котором она больше подвергается коррозии с поверхности, так как диффузия одних металлов и неметаллов в составе других (взаимное проникновение и распределение) для разных температур может существенно отличаться.


- Обработка алюминия относительно лёгкая по сравнению с вязкой и упругой нержавейкой.

- Сварка нержавейки выполняется обычными электродами. Попытка ими же сварить алюминиевый сплав при похожем рабочем токе приведёт к разбрызгиванию и выгоранию состава, шва здесь не получится. Сварка алюминия производится электродами из алюминиевых штырей – специальный сварочный алюминий не даёт прилипать электродам, а аккуратно наплавляет шов, соединяя детали.

- Нержавейка заметно хуже проводит даже высокочастотные токи. Это легко выявить, подключив существенную электрическую нагрузку к источнику тока через стальные и алюминиевые провода по отдельности. Благодаря более высокому сопротивлению стальные провода греются больше.

- В отличие от нержавейки алюминий впитывает запахи продуктов питания и всевозможной бытовой химии.

Конкретный выбор делается на основе требований. Бывают случаи, когда вкладываться в нержавеющую сталь нет смысла: с поставленной задачей справится и алюминиевый сплав.
Способы отличия
Отличить нержавеющую сталь от алюминия можно, поставив изделие на весы. Даже малоопытный в этом вопросе пользователь отличит лёгкий материал от тяжёлого. Оценить, насколько тяжёлой или лёгкой была бы кастрюля, легко: наблюдательный пользователь сразу обратит внимание на толщину стенок посуды и её габариты.


Если перед вами оказалась не посуда, а, к примеру, велосипед, то определить, сделана ли рама из стали или из алюминия, можно, сравнив его с другим таким же. У велосипедов с разными рамами стальная добавит, столько веса, что вес велосипеда достигнет 14-17 кг в зависимости от обвеса (остальных компонентов и деталей). В случае велосипеда с рамой из алюминия общий его вес едва ли превысит 7-11 кг. Наконец, можно понять, из чего сделана рама, прокатившись на нём. Стальная рама гасит вибрации на дорогах с каменистым и грунтовым покрытием, с асфальтом, чья ровность и гладкость нарушена. Алюминиевая же передаёт малейшие толчки, никак не смягчая их: свойство «козлить» (подкидывать ездока при езде по неровной дороге) является причиной ещё одного недостатка: накопив усталостные напряжения, такая рама лопается, чего не скажешь о стальной.


И хотя из нержавейки велосипеды изготавливаются в основном лишь по спецзаказу, единичными экземплярами (чтобы избежать трат на окраску рамы), использование её вместо обычной ржавеющей стали вряд ли изменило бы её амортизационные свойства.
Что лучше выбрать?
В первую очередь выбор зависит от характера, особенностей нагрузки. Околопредельные нагрузки алюминий не выдержит. Например, если использовать вместо стальных толстостенных профуголков уголки из алюминия с такой же толщиной стенок в качестве направляющих для кровли, то они прогнутся из-за резко возросшей нагрузки как от собственного веса кровельных профлистов, так и от слоя снега на нём в зимнее время. Заменить толстостенными уголками или профилем, профтрубой из алюминия можно лишь аналогичные по габаритам, но тонкостенные стальные элементы и детали.

Для изготовления, например, движущихся шестерёнок, штифтов, роликов, испытывающих частую, периодическую перегрузку, подойдёт не нержавеющая, а особая техническая сталь, рассчитанная на постоянное трение, обладающая износостойкостью. Алюминий, даже литой, здесь не справится: алюминиевые детали и комплектующие стираются ещё быстрее по причине своей относительной мягкости. Применение в составе алюминиевых сплавов дополнительных присадок, повышающих жёсткость и прочность, не спасёт: цветмет никак не может соперничать с углеродисто-железными составами ни по твёрдости, ни по упругости. Алюминий в отличие от большинства сортов стали, включая и нержавейку, легко надламывается при однократном сгибании и последующем разгибании. Два и более полных цикла сгибания-разгибания полностью разрушат соединение или уже приданный на заводе изгиб, стык – он образуется не формовкой, как это бывает в случае с медью или низкоуглеродистой сталью, а отливается заранее в специальной форме. Разница в ломкости стали и алюминия при многочисленных деформациях весьма существенна, её трудно не заметить.



Определить в домашних условиях, что перед вами алюминий, а не сталь, можно, попытавшись царапнуть предмет другим цветметом, например, бронзовой подвеской или шайбой. Бронза заметно твёрже меди и алюминия – на нём она оставит глубокую царапину. Нержавейку поцарапать цветнометаллической деталью или предметом очень сложно: если царапина и образуется, то она будет очень тонкой и неглубокой, либо вместо неё останется лишь тупой и размытый след, а сама острая кромка царапающего предмета затупится о твёрдую и вязкую нержавейку.
По цвету царапины, соскоба нержавейка не имеет лёгкого серовато-голубовато-зеленоватого отлива светлого тона (что указывает на её явную цветную окраску), её окраска скорее нейтральная, беловато-сероватая, хотя металлический блеск всё тот же.


Не лишена смысла возможность проверить, нержавейка перед вами или алюминий, предмет или деталь с помощью магнита. Вопреки расхожему мнению, некоторые сорта нержавейки являются слабомагнитными, либо магнитятся интенсивно. Аустенитные сорта нержавеющей стали, к примеру, не намагничиваются, чего не скажешь о большинстве ферритовых сплавов: те как раз и являются ферромагнетиками.

Если речь идёт о советской посуде и столовых приборах, то на вилках и ложках, ножах прямо указывалось, что этот предмет сделан именно из нержавеющей стали.
Попробуйте согнуть столовый прибор. Узнать, алюминий ли это, можно, приложив определённую силу. Алюминиевая ложка или вилка легко гнётся, а нержавеющая более упругая. Чтобы согнуть ложку или вилку из нержавеющей стали, не всякий сделает это без помощи дополнительных инструментов, например, пассатижей или тисков. На рынке, разумеется, такую пробу выполнить не дадут, но, например, проверка изделия на магнитную восприимчивость не принесёт товарной единице никакого физического вреда. Однако уже купленная принадлежность может быть проверена наждачкой: нержавейка из-за её крайней трудности в обработке плохо поддаётся соскобам и зачистке, а вот с алюминиевого предмета слои металла счищаются быстро, такое изделие «пылит» стружкой.

Проверка нержавейки на подлинность с помощью концентрированной уксусной кислоты вряд ли приведёт к быстрой коррозии. Алюминиевый же сплав (любой) боится этой кислоты: он активнее даже цинка, хрома и марганца, от любых кислот быстро разрушается. Оксидная плёнка, которая тут же образовывается на алюминиевом изделии, вступает в реакцию с любой кислотой. Образуется солевой налёт, который не держится на поверхности. В результате предмет из этого металла разрушается с угрожающей скоростью.
алюминий
- Алюминий
- Д16
- Д16т
- В95
- АД31
- АМг1
- АМг2
- АМг3
- АМг4
- АМг5
- АМг6
- Бронза
- БрБ2
- БрАЖ9-4
- БрАЖН10-4-4
- БрОФ
- БрОЦС5-5-5
- БрАЖМц10-3-1,5
- Латунь
- Л63
- Л68
- ЛС59-1
- Медь
- М1
- М2
- М3
Алюминий (Al) – материал, из которого изготавливается большой ассортимент металлопроката. Этот металл востребован в различных сферах промышленности, строительстве и народном хозяйстве. Из него производят следующие разновидности продукции: листы, углы, профили, круги, рулоны, прутки, полосы, двутавры, швеллеры. Прочность, легкость обработки и доступная стоимость обусловили хороший спрос на данный продукт.
Физико-химические свойства
 Алюминий – 13-й элемент в таблице Менделеева, относится к легким металлам. Его цвет – серебристо-белый. В природе он встречается в виде соединений в силу своей сильной химической активности. В нормальных условиях на поверхности алюминия присутствует оксидная пленка, которая делает его невосприимчивым к окислителям и коррозии. При вступлении в реакцию со щелочью и растворами солей аммония она разрушается, и тогда этот металл используется как сильный восстановитель.
Алюминий – 13-й элемент в таблице Менделеева, относится к легким металлам. Его цвет – серебристо-белый. В природе он встречается в виде соединений в силу своей сильной химической активности. В нормальных условиях на поверхности алюминия присутствует оксидная пленка, которая делает его невосприимчивым к окислителям и коррозии. При вступлении в реакцию со щелочью и растворами солей аммония она разрушается, и тогда этот металл используется как сильный восстановитель.
К основным физическим свойствам относятся:
- Высокие прочностные характеристики за счет соединения с другими металлами;
- Небольшой вес – намного легче меди и железа;
- Стойкость к коррозии;
- Быстрое нагревание, как и у железа;
- Отличная электропроводность и теплопроводность;
- Устойчивость к огню, температурным перепадам;
- Возможность вторичной обработки;
- Не подверженность ржавчине в отличие от железа;
- Простота формования благодаря мягкости и пластичности – можно согнуть, смять и свернуть в трубочку.
Чтобы увеличить прочность, этот металл сплавляют с магнием, медью, кремнием. Алюминиевые сплавы остаются крепкими в условиях низких температур. Их все разделяют на литейные и деформируемые. Алюминиево-бронзовые – превосходят бронзу по химической стойкости.

Добыча
После кислорода и кремния этот металл – наиболее распространенный элемент в земной коре, где он присутствует в виде соединений с другими элементами. Его получают из алюминиевых руд. Наиболее высокое содержание (50% оксидов этого металла+глинозем, содержащий этот компонент) находится в бокситах, которые залегают на поверхности земли. Наилучшие залежи этих минералов расположены в экваториальных и тропических регионах.
Для их добычи используется сложное оборудование: краны, машины для раздачи глинозема, установка по газоочистке, электролизер. Также в ходе процедуры задействованы просторные помещения и мощная электросеть. Поэтому заводы по производству этого продукта обычно расположены вблизи электростанций. В современных условиях этот металл получают благодаря процессу Холла-Эру.
Область применения
Алюминиевая плита. Обладает шумоизолирующими свойствами, защищает от вибрации, огня и влаги. Из нее изготавливаются различные строительные конструкции, декоративные элементы крыш, окантовки, круги, балки, профили. Она – важный элемент в машиностроении, где ее используют как основу для несущих стоек. В авиационной промышленности эта продукция применяется для облицовки фюзеляжей и в самой конструкции планеров. Также этот продукт важен для получения топливного и гидравлического оборудования.
Алюминиевый лист. Благодаря разнообразию форм используется в декорировании зданий. Также он востребован при изготовлении каркасов, фильтров и вентиляционных коробов. Из него производят баки, канистры для продуктов, контейнеры, столешницы, мойки. Материал не вступает в реакции с пищей, не выделяет опасных веществ и не влияет на вкусовые качества.
Алюминиевая труба. Незаменима при обустройстве трубопроводов для добычи нефти, так как не вступает в реакции с веществами. Благодаря хорошей пропускной способности такая продукция – оптимальный вариант при разработке канализации и водопровода. Вода по ним двигается быстро, без образования пробок.
Алюминиевая проволока. Применяется для сварочных работ, при монтаже электролиний, в электротехнике, в системах грозозащиты. Является сырьем в производстве кабельной и проводниковой продукции. Также из нее производят инвентарь для торговли, элементы фасадов, дизайнерские детали для домов, посуду.
Алюминиевые уголки. Востребованы при изготовлении корпусной и мягкой мебели, рекламного оборудования, шкафов, стеллажей. Это любимый элемент дизайнеров, так как он не просто защищает мебельные конструкции, но и подчеркивает их оригинальность. Небольшие и узкие разновидности также востребованы при установке оконных рам. Крупные изделия – при монтаже крупногабаритных конструкций.
Алюминиевый пруток. Не намагничивается, не боится перепадов температуры, имеет хорошую электропроводность и легкий вес. Используется в станкостроении и машиностроении. Применяется в качестве заготовок для производства крепежей, стойких к агрессивным веществам. Из него получают детали редукторов, клапаны, силовые элементы, компоненты сварных конструкций, опорную арматуру.

Отличия алюминиевых сплавов
Сплавы АД1 представляют собой технический алюминий, содержат до 0,7% примесей, среди которых главная роль принадлежит кремнию и железу. Они стойкие к воздействиям химических веществ. Подходят в качестве материалов для резервуаров, прокладок, шайб. АД31 склонен к упрочнению при термической обработке, содержит: Al, Mg, Si. Имеет высокую пластичность, не подвержен ржавчине. Из него получаются сложные по форме полуфабрикаты. Он прост в обработке, хорошо поддается окрашиванию. Из него получают профили, емкости для перевозки азотной кислоты, продуктов питания. Также он является материалом для фляг, консервных банок, пробок бутылок.
В сплаве В95, помимо Al, присутствует цинк, магний и медь. Самый прочный среди всех разновидностей, поэтому востребован в конструкциях с высокой нагрузкой. Из него выпускают плиты, ленты, профили. Под точечной нагрузкой склонен к коррозийному разрушению.
Д16 очень распространен, представляет алюминиевый сплав с медью и магнием. Его можно деформировать в холодном и горячем состоянии. Не предназначен для сваривания. Сплав Д16т – дюралюминий, востребованный в авиа и судостроении. В три раза легче стали, не подвержен микроскопической деформации. Хорошо обрабатывается на токарных станках. Буква Т обозначает, что он искусственно состаренный. В таком состоянии он очень прочный, не подвержен коррозийному влиянию.
Под обозначением АМГ следует понимать алюминиево-магниевые сплавы. Не упрочняются термической обработкой. Незаменимы в технологиях глубокой штамповки. Морозоустойчивы, пластичны. Цифры, следующие за буквенными обозначениями, указывают на количество магния.
Сплав А5 – первичный алюминий, из которого делают проволоку, фольгу, слитки.
АМЦ содержит алюминий и марганец. Пластичный, но малопрочный. Среди достоинств таких сплавов – стойкость к коррозии, способность без труда свариваться контактной, газовой, атомно-водородной сваркой. Склонны к деформации как в холодном, так и в горячем состоянии в пределах 320-470 ° C.
Заполните данные ниже и наши менеджеры обязательно свяжутся с Вами в самое ближайшее время, а также проконсультируют по интересующим вопросам
Статьи
Свойства алюминия
Свойства алюминия
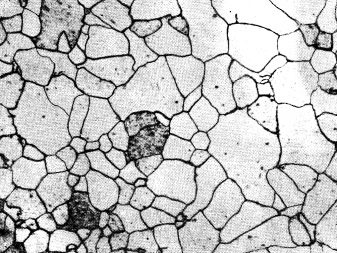
Алюминий — серебристо-белый легкий металл. Расположен в III группе Периодической системы элементов Д.И.Менделеева под номером 13; атомная масса алюминия — 26,98. Конфигурация внешней электронной оболочки 3s 2 3р; атомный радиус — 0,143 мм, ионный радиус А1 3+ (в скобках указаны координационные числа) 0,053 нм (4); 0,062 нм (5); 0,067 нм (6); энергия ионизации А1 -» А1 + -> А1 2+ —> А1 3+ — соответственно 5,984; 18,828; 28,44 эВ; сродство к электрону 0,5 эВ; электроотрицательность по Поллингу — 1,5; поперечное сечение захвата тепловых нейтронов — 215*10 -25 м 2 [3]. Алюминий имеет кубическую гранецентрированную кристаллическую решетку с параметрами: а = 0,40403 нм, z = 4, пространственная группа Fm3m. В природе существует один стабильный изотоп 27 А1.
Отличительные особенности алюминия — высокая электропроводимость, теплопроводность, коррозионная стойкость, малая плотность и отличная обрабатываемость давлением в холодном состоянии.
Физические свойства алюминия [2-6]
Механические свойства алюминия [4-6]
При охлаждении алюминия до температуры ниже 120 К его прочностные свойства в отличии от большинства металлов возрастают, а пластичность не изменяется (табл. 1.7).
Механические свойства алюминия различной чистоты
| Состояние | Содержание Аl, % | Предел прочности при растяжении σв2МПа | Предел текучести при растяжении σ.00,2, МПа | Относительное удлинение δ, % | Твердость по Бринеллю, НВ |
| Литой в землю | 99,996 | 50 | — | 45 | 13-15 |
| Литой в землю | 99,5 | 75 | — | 29 | 20 |
| Литой в землю | 99.0 | 85 | — | 20 | 25 |
| Литой в кокиль | 99,0 | 90 | — | 25 | 25 |
| Деформированный и отожженный | 99.0 | 90 | 30 | 30 | 25 |
| Деформированный | 99,0 | 140 | 100 | 12 | 32 |
| Литой в землю | 98,0 | 90 | 35 | 12,5 | 28 |
Технологические свойства алюминия [6]
Коррозионные свойства алюминия [6].
Алюминий и его сплавы характеризуются высокой коррозионной стойкостью в атмосферных условиях как сельской местности, так и городских промышленных районов.
Сернистый газ, сероводород, аммиак и другие газы, находящиеся в воздухе промышленных районов, не оказывают заметного влияния на скорость коррозии алюминия и его сплавов. Алюминий практически не корродирует в дистиллированной и чистой пресной (естественной) воде даже при высоких температурах (до 180 °С). Действие пара на алюминий и его сплавы также незначительно.
Вода, содержащая примеси щелочей, резко повышает скорость коррозии алюминия. При комнатной температуре скорость коррозии алюминия в аэрированной воде содержащей 0,1% едкого натрия — 16 мм/год; 0,1% соляной кислоты — 1 мм/год и 1% соды — 4 мм/год.
Алюминий и его сплавы, не содержащие меди, достаточно стойки в естественной (не загрязненной) морской воде. Сернокислые соли магния, натрия, алюминия, а также гипосульфит практически не действуют на технический алюминий. Скорость коррозии алюминия возрастает в присутствии в воде солей ртути, меди или ионов хлора, разрушающих защитную оксидную пленку на алюминии.
В концентрированной азотной кислоте при комнатной температуре алюминий и его сплавы устойчивы, но быстро разрушаются в разбавленных кислотах.
Слабые растворы серной кислоты, концентрацией до 10%, при комнатной температуре незначительно влияют на технический алюминий, но с повышением концентрации и температуры скорость коррозии резко возрастает. В концентрированной серной кислоте алюминий практически устойчив.
Соляная кислота быстро разрушает алюминий и его сплавы, особенно с повышением температуры. Такое же действие на алюминий оказывают растворы плавиковой и бромистоводородной кислот. Слабые растворы фосфорной (менее 1%), хромовой (до 10%) и борной (при всех концентрациях) кислот на алюминий и его сплавы действуют незначительно.
Органические кислоты — уксусная, масляная, лимонная, винная, а также кислые (незагрязненные) фруктовые соки, вино оказывают слабое действие на алюминий и его сплавы, за исключением щавелевой и муравьиной кислот.
Алюминий и его сплавы быстро разрушаются в растворах едких щелочей, однако в растворах аммиака они довольно стойки, особенно сплавы, содержащие магний. Амины на них действуют также незначительно.
Следует отметить, что алюминий и однофазные сплавы на алюминиевой основе более стойки в коррозионном отношении, чем сплавы двухфазные и многофазные.
Влияние примесей на свойства алюминия. На коррозионные, физические, механические и технологические свойства алюминия оказывают значительное влияние примеси различных элементов. Так, например, большинство примесей снижают электропроводность алюминия (рис. 1.1). Основные примеси в алюминии — железо и кремний. Железо снижает коррозионную стойкость, электропроводность и пластичность алюминия, но несколько повышает его прочность. Диаграмма состояния системы Al-Fe, приведенная на рис. 1.2, показывает, что железо незначительно растворяется в алюминии в твердом состоянии. При температуре эвтектики (655°С) растворимость железа достигает 0,052% и с понижением температуры граница твердого раствора а резко сдвигается в сторону алюминия. Железо в алюминии присутствует в виде самостоятельной фазы Al3Fe.
Железо — вредная примесь не только в алюминии, но и в сплавах алюминия с кремнием и магнием. Однако в жаропрочных алюминиевых сплавах железо (в сочетании с никелм) является полезной примесью.
Обычная примесь в алюминии — кремний. В сплавах на алюминиевой основе кремний наряду с медью, магнием, цинком, а также марганцем, никелем и хромом вводится в качестве основного компонента. Образующиеся при этом соединения CuAl2, Mg2Si, CuMgAl2 и др. являются эффективными упрочнителями алюминиевых сплавов.
Из диаграммы состояния алюминий-кремний (рис. 1.3) видно, что при температуре эвтектики 577°С в алюминии растворяется до 1,65% кремния. С понижением температуры область твердого раствора α резко уменьшается.

Примеси кальция и других элементов, присутствующих в стандартных марках алюминия в незначительном количестве, не имеют практического значения. Небольшие добавки церия, натрия и титана оказывают существенное влияние на структуру и свойства определенных алюминиевых сплавов.
Водород хорошо растворяется в алюминии и оказывает отрицательное влияние на его свойства, вызывая при литье пористость. Азот при высоких температурах вступает в реакцию с алюминием с образованием тугоплавкого соединения.
Токсикологические свойства алюминия [7]. В соответствии с ГОСТом по степени воздействия на организм человека алюминиевую пыль относят к III классу опасности. Предельно-допустимая концентрация (ПДК) в воздухе пыли металлического алюминия и его оксидов составляет 2 мг/м 3 .
При постоянном вдыхании пыли металлического алюминия и его оксида может возникнуть алюминоз легких. Рабочие, подвергшиеся воздействию пыли, должны проходить периодически флюорографическое обследование. У рабочих, занятых в производстве алюминия, часты катары верхних дыхательных путей (рипиты, фарингиты).
Наибольшую опасность для здоровья представляет процесс электролиза глинозема, протекающий в расплавленном криолите (Na3AlF6) при температуре 950 °С. Электролиз расплавленных солей может сопровождаться выбросами большого количества фторидной пыли, фторсодержащих газов, а также паров и частиц битума-компонента анодной массы. Рабочим, занятым на этой операции, также грозят ожоги кожи и глаз при попадании на них расплавленного металла. Во избежании несчастных случаев электролизные ванны необходимо надежно изолировать, рабочие должны иметь средства индивидуальной защиты:, противопылевые маски, очки. перчатки, фартуки, сапоги и т.д. В электролизных цехах должен регулярно проводиться контроль за содержанием пыли в воздухе.
ПДК алюминия и его оксида по ГОСТу и нормативам США приведены ниже:
* Предел кратковременного влияния, т.е. максимальная концентрация, воздействию которой человек может подвергаться не более 15 минут подряд при условии, что в течении дня допускается не более 4-х таких воздействий с промежутками не менее 60 минут.
** Величина порогового предела концентрации вещества, устанавливаемая американской конференцией государственных гигиенистов и определенная для 8-часового рабочего дня и 40-часовой рабочей недели.
- Гидродинамическая прочистка канализации: решение засоров
- Служба по дезинфекции: практические решения для дома и бизнеса
- Практическое применение средств индивидуальной защиты на работе
- Преимущества гидроструйной очистки поверхностей
- Армированная полиэтиленовая пленка для теплиц — как продлить срок службы