Электрохимическая полировка меди
Электрохимическая полировка меди
Химическое и электрохимическое полирование
Химическое полирование

В процессе полирования рекомендуется перемешивать раствор или встряхивать детали в емкости. Это дает возможность устранять скопление пузырьков газов на отдельных участках деталей, так как пузырьки газов понижают качество полирования. Одним из главных преимуществ химического полирования является его простота. Для получения требуемого результата достаточно обрабатываемую деталь на несколько минут погрузить в соответствующий раствор, без применения электрического тока, без механического воздействия. Метод не требует сложного оборудования.
К недостаткам такого полирования относится сложность корректирования (поддержание точных соотношений всех элементов в растворе путем добавления израсходованного элемента) растворов и малый срок их службы. Применяемые растворы чрезвычайно опасны для здоровья человека, и в домашних условиях без соответствующей подготовки проводить такое полирование нельзя. Блеск поверхности получается меньше, чем при электрохимическом полировании. Химическому полированию подвергаются в основном латунные или алюминиевые детали сложной конфигурации и небольших размеров, которые не требуют зеркального блеска.
Электрохимическое полирование

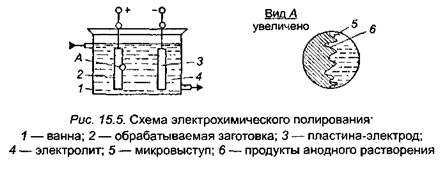
Для осуществления электрохимического полирования обрабатываемую деталь, являющуюся анодом (т.е. электродом, соединенным с положительным полюсом источника тока), надо поместить в ванну с электролитом. Вторым электродом служат катоды, изготовленные из меди. На схеме показано протекание процесса электрохимического полирования. Благодаря специально подбираемому составу электролита и создаваемым условиям (образование пленки 2 повышенного сопротивления) растворение осуществляется неравномерно. В первую очередь растворяются наиболее выступающие точки 3 (выступы), вследствие чего шероховатость уменьшается, а затем исчезает, и поверхность детали становится гладкой и блестящей. Избирательное растворение торчащих элементов протекает с одновременным получением блеска.
Удаление крупных выступов 3 называется макро-полированием, а растворение микроскопически малых неровностей 4 — микро-полированием. Если макро- и микро-полирование протекает одновременно, то поверхность приобретает гладкость и блеск. В ряде случаев эти качества могут быть несвязанными друг с другом, т.е. блеск может достигаться без сглаживания, а сглаживание — без блеска.
В процессе электрохимического полирования на поверхности анода (полируемой детали) образуется окисная или гидроокисная пленка. Если эта пленка равномерно покрывает поверхность, то она создает условия, необходимые для протекания микро-полирования. Внешняя часть этой пленки непрерывно растворяется в электролите. Поэтому для успешного проведения процесса необходимо создания условий, в которых существовало бы равновесие между скоростями образования окисной пленки и скоростью ее химического растворения с тем, чтобы толщина пленки поддерживалась неизменной. Наличие пленки обусловливает возможность обмена электронами между полируемым металлом и ионами электролита без опасности местного разрушения металла агрессивным электролитом.
Макро-полирование также является процессом, зависящим от наличия прианодной пленки. Будучи более толстой в углублениях и более тонкой на выступах, эта пленка способствует их ускоренному растворению, так как на выступах создается более высокая плотность тока, а электрическое сопротивление над ними меньше, чем над углублениями.
Эффективность действия пленки увеличивается с повышением ее внутреннего сопротивления. Электролиты, содержащие соли слабодиссоциирующих кислот или комплексные соли, повышают сопротивление пленки.
Кроме действия прианодной пленки на течение процесса электрохимического полирования влияют и другие факторы, в частности механическое перемешивание электролита (или движение анода), благоприятствующие утончению пленки за счет ее растворения или уменьшения толщины диффузионного слоя. Электролиты некоторых составов функционируют нормально только при нагреве. Общим правилом является то, что повышение температуры снижает скорость нейтрализации и повышает скорость растворения прианодной пленки.
Существенными факторами, влияющими на течение процесса электрохимического полирования, являются также плотность тока и напряжение.
На рисунке показана типичная зависимость плотности тока от напряжения в ванне при электрохимическом полировании.

На участке АБ повышение плотности тока почти пропорционально увеличению напряжения. На участке БВ режим нестабилен, наблюдается колебание тока и напряжения. Предельный ток, соответствующий участку ВГ, характеризует процесс формирования на аноде пассивной пленки. При этом повышение напряжения в довольно широком интервале не сопровождается изменением плотности тока. По достижении напряжения, соответствующего точке поворота Г на кривой, начинается новый процесс — образование газообразного кислорода.
В зависимости от состава электролита и обрабатываемого металла полирование ведут при режимах соответствующих различным участкам кривой. Так, полирование меди в фосфорной кислоте ведут при режиме предельного тока, когда не происходит образования кислорода.
Рецепты ванн и режимы для химического и электрохимического полирования
Химическое полирование деталей из углеродистой стали. Химическое полирование деталей из углеродистой стали можно выполнять в различных растворах. Один из них (в вес. %): 15-25% ортофосфорной кислоты, 2-4% азотной кислоты, 2-5% соляной кислоты, 81-60% воды. Режим работы: рабочая температура 80° С, выдержка 1-10 мин. В данном растворе производят также полирование нержавеющей стали. Химическое полирование деталей из стали выполнят также в следующем растворе: 25 г щавелевой кислоты, 13 г пергидроли, 0,1 г серной кислоты, до 1 л воды. Режим работы: рабочая температура 20° С, выдержка 30-60 мин.
Химическое полирование деталей из нержавеющей стали. Химическое полирование деталей из нержавеющей стали марки Х18Н9Т выполняют в растворе следующего состава: 40 см3 азотной кислоты, 70 см3 соляной кислоты, 230 см3 серной кислоты, 10 г/л столярного клея, 6 г/л хлористого натрия, 6 г/л красителя кислотного черного. Режим работы: рабочая температура 65-70°С, выдержка 5-30 мин.
Химическое полирование деталей из алюминия и его сплавов. Для полирования мелких алюминиевых деталей используют следующий состав раствора: 60 см3 ортофосфорной кислоты, 200 см3 серной кислоты, 150 см3 азотной кислоты, 5 г мочевины. Режим работы: рабочая температура 100- 110° С, выдержка 15-20 с. Полирование деталей из алюминиево-магниевого сплава АМг производят в одном из растворов следующего состава: 500 или 300 см3 ортофосфорной кислоты, 300 или 450 см3 серной кислоты (аккумуляторной), 150 или 170 см3 азотной кислоты.
Химическое полирование деталей из меди и, ее сплавов. Химическое полирование деталей из меди и ее сплавов выполняют в следующем растворе: 800 см3 серной кислоты; 20 см3 азотной кислоты; 1 см3 соляной кислоты; 200 см3 пергидроли; 20-40 см3 хромового ангидрида. Режим работы: рабочая температура 20-40°С, выдержка до 1-2 мин. Может быть также использован раствор: 250-270 см3 серной кислоты, 250-270 см3 азотной кислоты, 10-12 см3 нитрита натрия. Режим работы: рабочая температура 30-40° С, выдержка 1-3 мин.
Химическое полирование деталей из никеля. Для химического полирования деталей из никеля используют раствор (в вес. %) 45-60% ортофосфорной кислоты, 15-25% серной кислоты, 8-15% азотной кислоты, 10-20% соды. Режим работы: рабочая температура 65-70° С, выдержка 0,5-1 мин.
Электролитическое полирование деталей из углеродистой стали. Наиболее популярным является так называемый универсальный электролит для полирования деталей из черных и цветных металлов. Его состав следующий (в вес. %): 65% ортофосфорной кислоты, 15% серной кислоты, 6% хромового ангидрида, 14% воды. Режим работы: рабочая температура 70-90° С, анодная плотность тока 40-80 а/дм2, напряжение 6-8 в, выдержка 5-10 мин.
Электролитическое полирование деталей из нержавеющей стали. Детали из нержавеющей стали (хромоникелевой и хромоникельмолибденовой) полируют в растворе (в вес. %): 65% ортофосфорной кислоты, 15% серной кислоты, 5% хромового ангидрида, 12% глицерина, 3% воды. Режим работы: рабочая температура 45-70°С, анодная плотность тока 6-7 а/дм2, напряжение 4,5-6в, выдержка 4- 30 мин (для штампованных деталей 4-6 мин, для деталей после сварки или термической обработки 10-12 мин, для литых отпескоструенных деталей из стали Х18Н9Т около 30 мин).
Электролитическое полирование деталей из алюминия и его сплавов. Для полирования деталей из алюминия и сплавов АМг и АМц хорошо зарекомендовал себя электролит, следующего состава (в вес. %): 65-70% ортофосфорной кислоты, 8-10% хромового ангидрида, 20-27% воды. Режим работы: рабочая температура 70-80° С, плотность тока в свежеприготовленном растворе 10-30 а/дм2, в растворе насыщенном солями 10-20 а/дм2. Выдержка 5 мин и более. Реверсирование при применении свежеприготовленного раствора tа-10 сек, tк — 2 сек; при применении раствора насыщенного солями, tа — 10 сек, tк — 5 сек. Для полирования деталей из дюралюминия Д16-Т рекомендуется следующий состав раствора (в вес. %): 40% серной кислоты, 45% ортофосфорной кислоты, 3% хромового ангидрида, 11% воды. Режим работы: рабочая температура 60-80° С, анодная плотность тока 30-40 а/дм2, напряжение 15-18 в, выдержка — несколько минут.
Электролитическое полирование деталей из никеля и никелевых покрытий. Для полирования деталей из никеля рекомендуется раствор: 1200 г/л серной кислоты, 120-150 г/л ортофосфорной кислоты, 15-20 г/л лимонной кислоты. Режим работы: рабочая температура 20-30° С, анодная плотность тока 30-50 а/дм2, выдержка до 1 мин. Для полирования применяют также 70%-ный раствор серной кислоты. Анодная плотность тока 40 а/дм2, температура 40°С, продолжительность процесса 30 сек.
Электролитическое полирование деталей из меди и ее сплавов. Для полирования этих деталей применяют следующий электролит: 1200 г/л ортофосфорной кислоты, 120 г/л хромового ангидрида. Режим работы: рабочая температура 20-30°С, анодная плотность тока 35-50 а/дм2, выдержка 0,5-2 мин. Применяют также однокомпонентный раствор ортофосфорной кислоты при температуре 18-25°С; анодная плотность тока для деталей из меди 1,6 а/дм2, для деталей из медных сплавов 0,8-1 а/дм2, выдержка 10-20 мин.
Литература:
Бартл Д. Мудрох О. Технология химической и электрохимической обработки поверхности металлов. — М., 1961.
Гарбер М.И. Декоративное шлифование и полирование. — М., 1964.
Жаке П. Электрохимическое и химическое полирование. — М., 1959
Масловский В.В. Дудко П.Д. Полирование металлов и сплавов. — М.,1974.
Пяндрина Т.Н. Электрохимическая обработка металлов. — М., 1961.
Тегарт А.С. Электролитическое и химическое полирование металлов. — М., 1957.
Щиголев П.В. Электрохимическое и химическое полирование металлов. — М., 1958.
При использовании материала этого сайта необходимо устанавливать активные ссылки, видимые для пользователей и поисковых роботов.
Химическое и электрохимическое полирование металлов.
Электрохимическое и химическое полирование применяется как для декоративной обработки поверхности после нанесения покрытий, так и в процессе обработки деталей.
Электрохимическое полирование.
При электрохимическом полировании микрорельеф поверхности получается значительно более гладким, чем при механической обработке.
Покрытия, получаемые при электрохимическом полировании беспористые и мелкокристаллические, что способствует снижению коэффициента трения и позволяет придать деталям специальные оптические свойства. В процессе электрохимического полирования поверхность металла становится блестящей в результате различной скорости растворения микровыступов и углублений.
Эффект электрохимического полирования объясняется образованием на металле поверхностной тонкой оксидной пленки, предотвращающей травление. Толщина пленки неодинакова на микровыступах и микровпадинах, вследствие чего раствор при электрохимическом полировании сильнее действует на те участки, где пленка тоньше, т.е. на микровыступы.
Качество электрохимического полирования зависит от плотности тока, температуры электролита, состава раствора и времени электролиза.
Наибольшее распространение при электрохимическом полировании нашли электролиты на основе фосфорной кислоты, серной и хромовой. Для повышения вязкости растворов вводят глицерин, и метилцеллюлозу. В качестве ингибиторов травления в электролиты электрохимического полирования добавляют сульфоуреид, триэтаноламин и др.
Химическое полирование.
Химический способ полирования имеет много общего с электрохимическим. Возникновение блеска на поверхности деталей здесь, как и при электрохимическом полировании, также связан с наличием тонкой пленки, предотвращающей травление в углублениях металла.
Преимущественное растворение выступов при химическом полировании достигается как за счет их повышенной химической активности, так и вследствие большей скорости диффузии ионов металла и свежего электролита.

Электрохимическое полирование стальных деталей.
Сравнительная характеристика процессов электрохимического и химического полирования.
Основными преимуществами процесса электрохимического полирования являются высокая производительность, хорошее сцепление гальванических покрытий с электрополированной поверхностью, возможность исключить операцию обезжиривания, необходимую при механической полировке.
К недостаткам процесса электрохимического полирования относятся необходимость в частой смене электролитов из-за отсутствия универсального для различных металлов; необходимость механической полировки поверхности перед электрохимическим полированием; повышенный расход электроэнергии.
Преимущество химического полирования перед электрохимическим в том, что не требуется применение источников постоянного питания. Химическому полированию подвергаются в основном латунные или алюминиевые детали любой сложной конфигурации и размеров, которые не требуют зеркального блеска.
Недостатки химического полирования по сравнению с электрохимическим — меньший блеск, большая агрессивность растворов и их недолговечность.
Составы электролитов для химического и электрохимического полирования металлов.
Большинство электролитов для электрохимического полирования стали, основаны на смесях растворов ортофосфорной и серной кислот с добавкой хромового ангидрида.
Электролит электрохимического полирования с содержанием 500–1100г/л фосфорной кислоты, 250–550г/л серной и 30 г/л хромового ангидрида является универсальным для электрохимического полирования всех видов стали, включая 12Х18Н9Т.
Режим электрохимического полирования: температура 60–80 0 С, плотность тока 15–80 А/дм 2 , время 1–10 минут.
Для электрохимического полирования стали 12Х18Н9Т возможно применять электролиты, содержащие ПАВ. Съем металла при электрохимическом полировании происходит интенсивнее в электролите: фосфорная кислота 730 г/л, серная – 580–725, триэтаноламин 4–6 г/л, катапин 0,5–1,0 при 60–80 0 С, плотность тока 20–50 А/дм 2 , время 3–5 минут.
Химическое полирование стали, в отличие от электрохимического, применяют реже, хотя проще в применении и имеет ряд преимуществ. Раствор для химического полирования стали 12Х18Н9Т содержит (г/л): серную кислоту 620–630, азотную 60–70, соляную 70–80, хлорид натрия 1-12, краситель кислотный черный 3М 3–5. Температура 70–75 0 С, время 5–10 минут.
Для электрохимического полирования меди и ее сплавов применяют растворы фосфорной кислоты с хромовым ангидридом: фосфорная кислота 850–900 г/л, хромовый ангидрид 100–150 г/л, температура 30–40 0 С, плотность тока 20–50 А/дм 2 .
Химическое полирование меди проводят в растворе (г/л) фосфорной кислоты 930–950, азотной 280–290 и уксусной 230–260 при комнатной температуре (в отличие от электрохимического) в течение 1–5 минут.
Электрохимическое полирование алюминия и его сплавов происходит в том случае, если скорость растворения оксидной пленки на поверхности превышает скорость ее образования. Электролит электрохимического полирования содержит смесь фосфорной кислоты (730–900г/л), серной (580–725г/л) и ПАВ (триэтаноламин 4–6 г/л, катапин БПВ 0,5 – 1,0 г/л). Режим электрохимического полирования: температура 60–80 0 С, плотность тока 10–50 А/дм 2 , время 3–5 минут.
Для электрохимического полирования сплавов алюминия с высоким содержанием кремния рекомендуется состав (масс. доли): плавиковая кислота 0,13; глицерин 0,54; вода 0,33. температура 20–25 0 С, плотность тока 20 А/дм 2 , время 10–15 минут.
Химическое полирование алюминиевых деформируемых сплавов проводят в растворе фосфорной кислоты 1500–1600 г/л с добавкой нитрата аммония 85–100 г/л при 95–100 0 С до 5 минут.
Электрохимическое полирование никеля проводят в электролите: 1000-1100 г/л серной кислоты при 20-30 0 С и плотности тока 20-40 А/дм 2 в течение 2-х минут.
Качество электрохимического и химического полирования деталей, как и всех гальванических процессов, зависит от подготовки поверхности (см. «Первые шаги в гальванике часть 2.») и точности выполнения технологических операций (состава электролита электрохимического полирования, режимов процесса).
При выполнении процессов электрохимического и химического полирования необходимо соблюдать технику безопасности (см. «Безопасная гальваника»).
7 простых способов полировки латуни до зеркала
Как и чем отполировать латунь в домашних условиях. Народные рецепты полировки меди, латуни и других медных сплавов. Промышленные способы химической полировки до зеркального блеска.

Медь и ее производственный металл латунь (смесь меди с цинком) повсеместно используются в различных сферах жизни и деятельности человека, в том числе и в быту. Дверные ручки статуэтки, чайники и кофеварки, медные полосы и другие предметы хозяйства и интерьера часто выполняются из меди или латуни, ведь эти металлы не только эстетичны, но и практичны. Однако со временем поверхность изделий из меди и ее сплавов может потускнеть, может появиться специфический налет, который является результатом взаимодействия латуни и меди с составляющими элементами кислорода. Полировка латуни – несложный процесс, который можно осуществить в домашних условиях с помощью подручных средств и убрать окиси с поверхности медных сплавов.
Простые народные способы полировки латуни и меди
Латунь как сплав меди и цинка не является капризным металлом: его чистку можно произвести, не прибегая к промышленным методам. В качестве полироли для латуни и меди можно использовать подручные средства, которые хорошо показывают себя в чистке медных сплавов. Использовать можно и зубную пасту, и средство для мытья посуды, и хозяйственное мыло – все эти нехитрые приспособления помогут вам вернуть медным вещицам привлекательный вид. Однако если вы вознамерились отполировать медь и латунь до зеркального блеска, то вам могут прийти на помощь народные способы чистки латуни и меди.
Поваренная соль и молочная сыворотка
Для того чтобы вернуть медным и латунным изделиям первозданный вид, можно использовать следующую смесь:
- молочная сыворотка – 200 мл;
- поваренная соль – 1 ч. л.
Чтобы отполировать латунь, нет необходимости погружать изделие в раствор. Достаточно смочить небольшой кусок ветоши и тщательно обработать поверхность предмета из меди или латуни.
После полировки латунь и другие медные сплавы тщательно промываются прохладной проточной водой. После такой обработки изделием сразу можно пользоваться.
Лимонный сок и поваренная соль

Лимонный сок и поваренная соль в симбиозе могут оказать отличное очищающее воздействие на поверхности предметов из латуни и других медных сплавов. Для того чтобы применить данный метод на практике, лимон нужно разделить на две части поперек, а места разрезов посыпать солью. Удерживая половинку лимона за основание, мякотью нужно обработать проблемные участки меди.
После всех манипуляций, когда смесь из лимонного сока и соли разъест налет окиси, изделие необходимо промыть, вытереть насухо, после чего отполировать небольшим куском мягкой ткани.
Полировка при помощи кетчупа
С полировкой медных вещей справится даже самый дешевый соус.
На предмет, нуждающийся в полировке, необходимо нанести небольшое количество кетчупа, распределив его равномерно по всей поверхности, оставить на несколько минут, чтобы пошла реакция разрушения компонентов окиси.
Излишки кетчупа убираются ватным диском, губкой или тканью, после чего изделие необходимо тщательно промыть. Данная процедура вернет латунному изделию первоначальный блеск.
Смесь на основе соли, уксуса и муки
Для приготовления мучной смеси для полировки медных сплавов, в том числе и латуни, понадобятся:
- уксус – 1 стакан;
- соль – 1 ст. л;
- мука – 2–3 ст. л.
В первую очередь соль необходимо смешать с уксусом в установленных пропорциях. Далее добавляется мука до образования кашицы средней вязкости. Смесь можно использовать двумя способами в зависимости от вида предмета:
- Тесто необходимо нанести на изделие из латуни плотным слоем на 30–40 минут, после чего поверхность хорошо обрабатывается щеткой и промывается.

- Если в полировке нуждается внутренняя часть медной посуды, то тесто помещается непосредственно на дно. Смесь необходимо распределить по всей площади, которая нуждается в чистке, после чего емкость помещается на средний огонь. Уксус и муку вываривают, после чего излишки смеси убираются посредством щетки с жесткой щетиной.
В первом случае эффективность «мучного» способа полировки можно повысить, если добавить в смесь небольшое количество древесных опилок.
Паста на основе мела и аммиака
- раствор аммиака 25%;
- измельченный мел (известь);
- воду.
На 100 мл воды потребуется 50 мл аммиачного раствора и 20 г мела. Паста наносится на поверхность изделия из латуни и других медных сплавов на 20 минут, после чего обрабатывается щеткой повышенной жестокости и промывается водой.
Мелкие изделия типа монет полностью погружают в раствор аммиака и мела.
Использование хозяйственного мыла

Хозяйственное мыло – это действенный и экономичный способ вернуть изделию из латуни или меди первоначальный вид при любых габаритах при условии незапущенной окиси.
Понадобится кусок обычного неотбеленного хозяйственного мыла 72%. Его необходимо измельчить и растворить в теплой воде. Изделие из латуни помещается в мыльный раствор на 1–3 суток, в течение которых произойдет естественная полировка.
После процедуры изделие из латуни обрабатывается щеткой, промывается и вытирается насухо.
Полироль из керосина и мела
- Ветошью или ватным диском изделие из латуни смазывается керосином по всей поверхности.
- Далее необходимо немного смочить кусок мягкой ткани, набрать на небольшой участок толченый мел и произвести им полировку изделия.
- После манипуляций нужно тщательно промыть объект чистки водой.
Данный способ полировки латуни и меди поможет вернуть изделию зеркальный блеск.
Химическое и электрохимическое полирование меди и латуни
Химическая и электромеханическая полировка меди и латуни дает максимально эффективный результат, однако лучше всего эти методы использовать в промышленных условиях, так как применяемые во время чистки латуни химические реагенты могут причинить вред организму.
Химическая полировка

Химическая полировка медных сплавов и других видов изделий заключается в том, что предмет, нуждающийся в чистке, помещают в специальный резервуар, наполненный раствором из различных реагентов и кислот. Химическое средство используют для образования специфических реакций, которые разрушающе воздействуют на неровности, шероховатости и налет окиси.
Изделие из меди выдерживают в растворе необходимое для осуществления химической реакции время, после чего к нему возвращается первоначальный привлекательный вид.
Электрохимическая полировка
Электролит помещается в специальную ванну с дополнительной прослойкой из свинца или полиэтилена и нагревается до температуры 60–90 градусов по Цельсию. К детали из медных сплавов присоединяют катоды из свинца. Плотность тока соответствует 10–50 А/дм². Деталь должна обрабатываться в растворе электролита приблизительно 5 минут.
Полировка при помощи галтовки

Полировка латуни и меди посредством галтовочного оборудования наиболее популярна по сравнению с другими специализированными методиками чистки металла ввиду следующих причин:
- Экономичность. В стоимость полировки входит специальный компонент, который расходуется в количестве 100 г за час обработки 100 л материала (100 литров равны массе медных изделий, помещаемых в галтовочный резервуар).
- Экономичность. Галтовка не содержит химических реагентов, опасных для жизнедеятельности организмов. Раствор галтовочных компонентов подвергается физическим методам очистки.
- Универсальность. Галтовочное оборудование может не только осуществить полировку меди и латуни, но также скорректировать форму очищаемых изделий.
К недостаткам метода галтовки относится загрязнение рабочей поверхности галтовочного аппарата и длительность финишного этапа полировки, которая призвана придать изделию из латуни зеркальный блеск. Процесс может длиться от 3 часов.
Полировка изделий из медных сплавов осуществляется в несколько этапов:
- Глубокая шлифовка специальным наполнителем высокой абразивности, которая убирает царапины, неровности и иные дефекты.
- Мягкая шлифовка наполнителем с мелкой абразивностью. Цель этапа – подготовка изделия к финишной обработке.
- Завершающий этап, необходимый для полной коррекции состояния изделия из меди и латуни и придания ему зеркального блеска.
Если вам приходилось на практике применять некоторые способы полировки латуни и меди, приведенные в данной статье, поделитесь своим опытом в комментариях.
Способ электрохимического полирования меди
Использование: в металлургии, электротехнике , радиоэлектронике. Сущность изобретения: полирование ведут на аноде в потенциостатическом режиме при напряжении 1,8-2,5 В, плотности тока 1,5 -4 А/дм , температура 17 — 30°С. Электролит содержит , мае. %: ортофосфорную кислоту 70 — 85, металлический алюминий 0.05 — 0,2.
СОЦИАЛ ИСТИЧ Е С К ИХ
РЕСПУБЛИК (я)я С 25 F 3/22
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР (21) 4663563/26 (22) 20.03.89 (46) 15,10,92. Бюл, ¹ 38 (71) Симферопольский государственный университет им, М.В,Фрунзе (72) Д,Б.Сгндулов и В.Г.Кинберг (56) Charles 1. Tansf, Metal Tinishing, 58, 10, 1983, 63 — 71, Авторское свидетельство СССР № 528886, кл. G 25 F 3/22, 1973, Изобретение относится к электрохимической обработке металлов и может быть использовано в металлургии, электротехнике, радиоэлектронике и других областях техники.
Известен способ полирования меди в электролите на основе ортофосфорной кислоты с добавкой ионов меди и поверхностно активных веществ.
В качестве прототипа выбран способ электрохимического полирования меди в
75% растворе ортофосфорной кислоты с добавкой 0,5 — 1% металлического алюминия при температуре 50 — 55 С и плотности тока
15 — 30 А/дм, Основные недостатки способа заключаются в том, что необходимо поддерживать достаточно высокую температуру ванны, высокую плотность тока, При этом наблюдается незначительное улучшение поверхности с Ra = 0,78 мкм до 0,65 мкм при трехминутной обработке и с 0,6 мкм до 0.53 мкм при пятиминутной обработке.
Целью изобретения является снижение шероховатости и увеличение отражательной способности поверхности обрабатываемого изделия.
„„Я ) „„1768674 А1 (54) СПОСОБ ЭЛЕКТРОХИМИЧ ЕСКОГО
ПОЛИРОВАНИЯ МЕДИ (57) Использование: в металлургии, электротехнике, радиоэлектронике. Сущность изобретения: полирование ведут на аноде в потенциостатическом режиме при напряжении 1,8 — 2,5 В, плотности тока 1,5 — 4 А/дм, температура 17 — 30 С. Электролит содержит, мас. ортофосфорную кислоту 70 — 85, металлический ал юминий 0.05 — 0,2.
Сущность изобретения заключается в анодной обработке изделий из меди в электролите на основе ортофосфорной кислоты и металлического алюминия; обработку ведут в потенциостатическом режиме при напряжении 1,8 — 2,5 В, плотности тока 1,5—
4 А/дм, температуре 17 — 30 С при следующем соотношении компонентов, мас,% ортофосфорная кислота 70 — 85
Металлический алюминий 0,05 — 0,2
Электролит готовят путем растворения алюминия в ортофосфорной кислоте, тщательно перемешивают при 18 — 25 С, Шероховатость поверхности определяли на профилографе марки 283, коэффициент отражения — на спектрофотометре марки СФ 4А с приставкой П30-2, Пример 1, Цилиндр 150 мм и длиной
400 мм помещали в электрихимическую ванну в качестве анода. в которой в качестве электролита была залита 77% ортофосфорная кислота с добавкой 0,1% алюминия.
Температуру в ванне поддерживали
20„,21 С, цилиндрический катод был помещен внутрь обрабатываемого цилиндра.
Потенциал 1,8 В, анодная плотность тока
1,5 А.дм . После 90 мин. электрохимической полировки (9 циклов по 10 мин. с двухминутной паузой) Ra уменьшалась с
0,15 мкм до 0,025 мкм.
Пример 2. Медный диск диаметром
180 мм помещали в электрохимическую ванну, в которой в качестве электролита была залита 85% ортофосфорная кислота с добавкой 0,2% алюминия, В качестве катода использовали медную пластинку. Температуру в ванне поддерживали; 29. 30О, потенциал 2,5 В, анодную плотность тока
4,0 А.дм . После 180 мин. электрохимической полировки (18 циклов по 10 мин. с двухминутной паузой) R> уменьшалось с
2,2 мкм до 0,21 мкм.
Пример 3. Медный цилиндр диаметром 150 мм и длиной 400 мм помещали в электрохимическую ванну в качестве анода, в которой в качестве электролита была залита 80% ортофосфорная кислота с добавкой
0,15% алюминия. В качестве катода использовали медную трубку, помещенную внутрь цилиндра, Температуру в ванне поддерживали 24. 25 С, Потенциал повышали с 2,1 В до 2,4 В ступенчато, выдерживая при каждом потенциале 2,1 В, 2,2 В, 2,3 B в течение 1 минуты, а при 2,4 В в течение 7 минут, При этом анодная плотность тока не превышала 3,7 А,дм, в процессе обработки было сделано шесть указанных циклов, В результате чего Ra изменилось от 1,06 мкм до 0,15 мкм.
Пример 4. Медный цилиндр диаметром 150 мм и длиной 160 мм помещали в электрохимическую ванну в качестве анода, в которой была залита 82 ортофосфорная кислота с добавкой 0,05% алюминия, В качестве катода использовали медную трубу.
Температуру в ванне поддерживали
24. 25ОС. Потенциал повышали с 2,1 В до
2,4 B ступенчато, выдерживая при потенциале 2,1 В, 2,2 В, 2,3 В в течение 1 минуты, а при 2,4 B в течение 7 минут анодная плотность тока не выше 3,55 А,дм . Число указанных ступенчатых циклов составило 15, В результате чего уменьшилось R> с 2,1 мкм до
Пример 5, Медную трубу диаметром
150 мм и длиной 400 мм помещали в электрохимическую ванну в качестве анода, в которую была залита 70% ортофосфорная уислота с добавкой 0,1% алюминия. Температуру в ванне поддерживали на уровне
24. 25 C. Потенциал 2 3 В, анодная плотность тока 3,8 А.дм . После 180 мин. электрохимической полировки (18 циклов по 10 мин. с двухминутными паузами) R> уменьшилось с 2,2 мкм до 0,54 мкм.
Пример 6. Медный резонатор длиной
1410 мм, имеющей в сечении форму эллипса с большой полуосью R = 800 мм и малой полуосью R = 450 мм помещали в электрохимическую ванну в качестве анода, в которую была залита 85% ортофосфорная кислота в количестве 99,90% с добавкой алюминия в количестве 0,10%. Температуру в ванне поддерживали на уровне 17 С, плотность тока не превышала 1,5 Аlдм . Потенциал увеличивали ступенчато с 1,8 В до 2,2 В, Время выдержки при 1,8 В, 1,9 В, 2,0В, 2,1 В по 1 минуте и при 2,2 В с выдержкой 7 минут.
Таких циклов было проведено шесть. После обработки из резонатора были вырезаны образцы для освидетельствования, при этом коэффициент отражения составил 95%, а шероховатость уменьшилась с R> = 0,20 мкм до R> = 0,042 мкм.
Сравнительный анализ приведенных данных говорит об эффективности предлагаемого способа и предпочтительности его использования.
Кроме того, уменьшение плотности тока и температуры в предлагаемом способе приводит к снижению энергозатрат и улучшению условий труда, например, уменьшению газовыделения на электродах или при испарениях с поверхности ванны, Формула изобретения
Способ электрохимического полирования меди, включающий анодную обработку в электролите на основе ортофосфорной кислоты и металлического алюминия, о тл и ч а ю шийся тем, что, с целью снижения шероховатости и увеличения отражательной способности поверхности, анодную обработку ведут в потенциостатическом режиме при напряжении 1,8 — 2,5 В, плотности тока 1,5 — 4 А/дм, температуре 17 — 30 С при следующем соотношении компонентов, мас.%: ортофосфорная кислота 70 — 85; металлический алюминий 0,05 — 0,2
Электрохимическая полировка металлов — описание процесса
Металлическому изделию можно придать блеск различными способами. Для этого не обязательно использовать специальные покрытия, можно воспользоваться методом полировки. Она может быть механической, например, с помощью наждачных кругов, химической — когда металл погружают в специальный раствор, а также электрохимической. В этом случае сочетается воздействие химических компонентов и электроразрядов, которые запускают определенные реакции или усиливают их. Электрохимическая полировка металлов может быть выполнена и в обычных домашних условиях, если собрать все необходимое оборудование.

- Описание процесса
- Оборудование и химикаты
- Пропорции создания хим состава
- Область применения
- Преимущества и недостатки
Описание процесса
Во время электрохимического полирования обрабатываемая поверхность металла приобретает зеркальный блеск. Также уменьшаются имеющиеся шероховатости. Процесс происходит следующим образом:
- Деталь считается анодом, то есть, электродом, несущим положительный заряд. Ее необходимо поместить в ванну со специальным составом.
- Еще один важный компонент — катоды, которые необходимы для осуществления реакции.
- В результате воздействия протекает реакция, и происходит растворение. Оно неравномерно, сначала удаляются самые заметные шероховатости, которые выступают над поверхностью больше всего. Одновременно происходит полировка — изделие приобретает зеркальный блеск.
Удаление заметных больших неровностей называется макрополированием, а сглаживание мелких дефектов — это микрополирование. Если эти процессы во время проведения обработки протекают одновременно и равномерно, то изделие приобретает блеск и гладкость. Возможно и такое, что блеск будет получен без сглаживания или наоборот. Два вида полирования не обязательно связаны.
Химическая полировка металла приводит к тому, что на поверхности обрабатываемой детали во время процесса образуется особая пленка. По составу она может быть оксидной или гидроксидной. Если она равномерно охватывает всю поверхность, это создает условия для микрополирования. При этом внешняя часть покрытия, располагающаяся на поверхности, непрерывно растворяется. Чтобы получить возможность провести микрополирование, необходимо обеспечить поддержание равновесия между непрерывным образованием покрытия и растворением, во время работы с деталью толщина слоя должна оставаться неизменной. Это позволит электронам обрабатываемого металла и применяемого состава в процессе взаимодействовать без опасности растворения металлического изделия в агрессивной среде.
Макрополирование тоже напрямую зависит от образующейся пленки. Она покрывает изделие неравномерно, на выступающих неровностях этот слой более тонкий, поэтому они быстрее растворяются, за счет воздействия тока.
СОВЕТ: эффективность общего воздействия полирующего состава можно повысить, если использовать для обработки электролиты, содержащие в своем составе соли слабо диссоциирующих кислот, которые увеличивают общее сопротивление покрытия.
Кроме этого играет роль механическое воздействие, заключающееся в перемешивании. Может уменьшаться толщина пленки или диффузный слой. Некоторые используемые электролиты выполняют свою функцию только при нагреве, также общее правило, которое действует для всех составов — при нагревании снижается нейтрализация, а скорость растворения пленки повышается. Плотность тока и уровень напряжения также входят в число факторов, оказывающих серьезное влияние на процесс. Например, если необходимо провести полировку медных изделий, то для нее подбирается состав с фосфорной кислотой и устанавливается предельный режим тока без образования кислорода. Именно поэтому важно точно соблюдать все необходимые параметры, чтобы добиться качественной полировки.
Оборудование и химикаты
Для работы с различными металлами необходимо подобрать соответствующие электролиты, которые помогут добиться нужного результата:
- Чаще всего применяются составы на основе кислоты различного вида — серной, фосфорной или хромовой.
- Глицерин может быть добавлен для увеличения общей вязкости, если это потребуется.
- Сульфоуреид выступает в роли ингибитора травления.
- Для очистки различных изделий после проведения процедуры могут применяться различные растворители или щелочные средства. Нередко используются составы с поверхностно-активными действующими веществами.
Пропорции создания хим состава
Полировка проводится в специальных ваннах. Важно помнить, что их составляющие относятся к токсичным веществам и опасны для здоровья, особенно если используется нагрев, поэтому обращаться со всеми компонентами необходимо с максимальной осторожностью, соблюдая положенную технику безопасности.
Изделия из цветных или черных металлов можно обрабатывать при помощи универсального состава, который окажет необходимое воздействие. Для этого следует добавить все компоненты, соблюдая пропорции. Ортофосфорная кислота составляет основу — 65%. Серной кислоты должно быть 15% и 14% обычной воды. Хромовый ангидрид занимает 6%.
Нержавеющую сталь можно полировать схожим составом, только воды в нем должно быть 13%, а еще следует добавить глицерин в соотношении 12%. Детали могут находиться в ванне до получаса, хотя штампованным изделиям требуется меньше времени для обработки.

Область применения
Химическая полировка металла используется, чтобы придать поверхности зеркальный блеск. Такое действие может быть направлено на придание деталям более привлекательного облика, если они находятся на виду и являются частью какой-то конструкции. Помимо эстетического назначения, полировка служит не только для красоты. С ее помощью можно избавить деталь от неровностей и шероховатостей, а также защитить от воздействия ржавчины, кислот и различных атмосферных явлений.
Преимущества и недостатки
Разные виды полировки имеют свои особенности, у электрохимической также есть плюсы и минусы:
- Этот способ благоприятно влияет на все свойства стали, увеличивая устойчивость к воздействию коррозии, а также облегчая проведение вытяжки и штамповки. Именно поэтому полировку такого типа часто используются как в лабораторных исследованиях, так и непосредственно для проведения различных работ в промышленности.
- Электрохимическая полировка является более дешевым и быстрым способом обработки металлических изделий. Если механический метод занял бы несколько часов, то с воздействием химикатов и электричества можно закончить дело за несколько минут, получив качественный результат.
- Полировка с электрохимическим воздействием незаменима при работе со сложными деталями, которые имеют различные полости и отверстия.

Химическая полировка металлов кроме преимуществ, имеет некоторые недостатки. Практически каждый существующий металл требует для проведения работы с ним специального состава, поэтому для разных изделий необходимо делать индивидуальные растворы. Также важно правильно подобрать соотношение компонентов, температуру нагрева, плотность тока — от этого напрямую зависит качество полученного результата. Перед проведением такой обработки может потребоваться предварительное механическое шлифование. Кроме того, процедура требует повышенного расхода электроэнергии. Однако при определенных условиях достоинства метода вполне перевешивают его недостатки, позволяя проводить полировку.
Электрохимическая полировка меди





8. Электрохимическая полировка
Электрохимическая полировка является более прогрессивным методом отделки изделий. Она применяется для полировки изделий с труднодоступными для механической полировки местами, обеспечивая равномерное полирование и хороший блеск всей поверхности изделия.
Для осуществления процесса электрохимической полировки обрабатываемые детали, являющиеся анодом (т. е. электродом, соединенным с положительным полюсом источника тока), помещают в электролитическую ванну. Вторым электродом являются электролитические катоды. При электрохимической полировке в первую очередь растворяются наиболее высокие выступы шероховатостей, затем поверхность выравнивается к становится гладкой и блестящей. Важными факторами, влияющими на процесс электрополировки, являются плотность тока, напряжение и температура. Режимы полировки выбираются в зависимости от состава электролита и обрабатываемого металла.
В настоящее время метод электрохимической полировки широко применяется для обработки золотых сплавов. Этим методом пользуются как для очистки поверхности золотых изделий после литья и паяния, так и для окончательной полировки изделий. Проводят электрохимическую полировку золотых сплавов в растворах электролита на основе тиомочевины (табл. 10) в ваннах, изготовленных из винипласта. В качестве анодов используются подвески из титановой проволоки, на которые подвешиваются обрабатываемые изделия. Контакт между изделием и подвеской должен быть плотным. В качестве катодов используются пластины из титана. На катодах в процессе электрополировки осаждается золото.
Чтобы предотвратить опадание осевшего золота на дно ванны и уменьшить разложение электролита, катоды помещают в чехлы из хлориновой ткани. Во время работы на поверхности электролита и на дне ванны образуется осадок серы, содержащий некоторое количество золота и серебра; этот осадок периодически сжигают для регенерации драгоценных металлов. После выполнения электрохимической полировки проводится следующая обработка: промывка в холодной дистиллированной воде; обработка изделий в депассивирующем растворе и последовательная промывка в дистиллированной воде в двух ваннах-уловителях. Растворы должны иметь комнатную температуру.
| Составляющая электролита | Массовая доля компонента, г/л | ||||
| ЗлСрПдМ 375-100-38 |
ЗлСрМ 583-80 |
ЗлСрМ 750-150 |
ЗлМНЦ 750 |
ЗлСрМ 958-20 |
|
| Тиомочевина | 60-90 | 60-90 | 60-90 | 60-90 | 60-90 |
| Кислота серная | 30-50 | 30-70 | 30-70 | 30-50 | 30-50 |
| Кислота молочная | — | 6,0-8,5 | 6,0-8,5 | — | — |
| Аммоний роданистый | 150-200 | 20-70 | 50-70 | 10-20 | — |
| Натрий хлористый | — | — | — | — | 10-20 |
( Примечания: 1). Для составления электролита применяется вода дистиллированная по ГОСТ 6700-72. 2). В обозначении марок буквы означают: Зл — золото, Ср — серебро, Пд — палладий, М — медь, Н — никель, Ц — цинк. Цифры, стоящие после, означают содержание золота, серебра, палладия, меди в процентах. Например, 37,5% — золота, 10% — серебра, 3,8% — палладия, остальное медь.)
Ванну для депассивирования готовят растворением в 500 мл дистиллированной воды сначала 50 мл серной кислоты (плотность 1,8 г/см 3 ), а затем 350 мл пергидроля (30%-ная перекись водорода). После перемешивания доводят объем раствора до 1 л. Учитывая, что перекись водорода быстро разлагается, нужно ежедневно контролировать содержимое ванны.
Процесс электрополировки золотых сплавов осуществляют при плотности тока на аноде (изделии) 3-5 А/дм 2 , на катоде 5-7 А/дм 2 . Температура электролита 50-60°С. Скорость съема металла при этом режиме велика, поэтому процесс длится 1-3 мин и ведется при визуальном контроле.
После проведения электрополировки партии изделий или по истечении определенного периода использования электролита для электрополировки изделий из золота необходимо производить регенерацию (извлечение) из него золота. Процесс этот производится следующим образом. Катоды вместе с чехлами вынимают из электролита, тщательно промывают в промывочных ваннах с водой, не допуская протока из ванны воды, а затем высушивают. С катодов снимают (соскребают) и собирают осадок, состоящий из растворенных в процессе анодной обработки драгоценных металлов (золота). Катодный остаток, оставшийся в чехлах, выгружают и остатки тщательно смывают с чехлов, промывают водой, высушивают и присоединяют к осадку, снятому с катодов. Перед началом регенерации промывные воды сливают вместе, упаривают и вводят в электролит анодной обработки. После этого электролит фильтруют и определяют содержание в нем золота. Отфильтрованный осадок высушивают и прожигают в муфельной печи при температуре 200-250°С в течение 1-1,5 ч.
Регенерацию золота из электролита проводят электрохимическим или химическим способом. Электрохимический способ регенерации золота основан на выделении золота из электролита и осаждении его на катоде с помощью электрического тока. При проведении регенерации золота из электролита в качестве катода используется листовой титан, помещенный в чехол хлорированной ткани. Анодом служит платина или графит. Катодная плоскость тока при концентрации золота в электролите более 1 г/л должна быть не более 0,5 А/дм 2 , а при концентрации золота менее 1 г/л катодная плотность тока должна быть не более 0,1 А/дм 2 .
Процесс ведут до достижения концентрации золота в электролите 0,01-0,05 г/л. Затем катод вместе с чехлами вынимают из электролита, тщательно промывают в промывочных ваннах и высушивают, после чего с катода снимают (соскребают) и собирают осадок, состоящий из растворенного в процессе регенерации золота. Катодный осадок, оставшийся в чехле, выгружают, остаток тщательно смывают с чехла, промывают водой, высушивают и присоединяют к осадку, снятому с катода.
Полученные в процессе регенерации катодные осадки объединяют с катодными осадками, извлеченными из основной ванны электрополирования и прокаливают в муфельной печи при температуре 600-700°С в течение 1-1,5 ч, после чего сплавляют.
После окончания регенерации золота электролит фильтруют, корректируют по тиомочевине и серной кислоте и вновь используют в ванне электрополировки. Отфильтрованный же осадок высушивают, прожигают в муфельной печи при температуре 200-250°С в течение 1-1,5 ч и объединяют с осадком, полученным при фильтрации электролита из основной ванны электрополировки. Эти осадки прокаливают в муфельной печи при температуре 600-700°С (возможно совместное прокаливание с катодными осадками) в течение 1-1,5 ч и затем сплавляют.
Химический способ регенерации золота основан на восстановлении металлов из растворов с помощью веществ, обладающих восстановительными свойствами. Электролит вместе с осадком, находящимся на дне ванны, переливают в термостойкую и кислотостойкую емкость, добавляют при перемешивании 30%-ный раствор едкого натра до достижения рН раствора, равного 9-10. Кислотность раствора определяется с помощью индикаторной бумаги. Затем в электролит вводят порциями раствор боргидрида натрия в таком количестве, чтобы массовое соотношение введенного боргидрида натрия и находящегося в растворе золота было 1:1.
После добавления расчетного количества боргидрида натрия раствор нагревают в течение 2-3 ч при температуре 70-80°С. При полном разложении боргидрида натрия, что видно по прекращению газовыделения и коагуляции осадка, раствор с черным мелкодисперсным осадком, состоящим из компонентов сплава, подвергнутого анодной обработке (электрополировке), охлаждают и отфильтровывают. Полноту осаждения проверяют добавлением к фильтру небольшого количества раствора боргидрида натрия. Осадок на фильтре промывают 1-2 раза в 5%-ном растворе серной кислоты, затем 2-3 раза горячей водой до нейтральной реакции. Осадок высушивают, прокаливают в муфельной печи при температуре 600-700°С в течение 1-1,5 ч и далее сплавляют.
Кроме электролитов частично золото оседает в депассивирующем растворе, откуда его также необходимо извлечь. Для этого депассивирующий раствор с выпавшим осадком переливают в термостойкую стеклянную или фарфоровую посуду и медленно нагревают до температуры 60-70°С. После полного разложения перекиси водорода, что видно по прекращению выделения мелких пузырьков газа, раствор кипятят в течение 15-20 мин и осадок отфильтровывают. Осадок промывают горячей водой, сушат и прокаливают в муфельной печи при температуре 600-700°С в течение 1-1,5 ч. Прокаленный осадок сплавляют или присоединяют к катодным осадкам и сплавляют вместе с ними.
Сплавленный слиток из осадков извлеченного золота подвергается лабораторному анализу для определения пробы, после чего он может быть долегирован для получения нужной пробы и использован в производстве.
В отличие от сплавов золота серебряные сплавы не подвергаются электрохимическому полированию, они в основном отбеливаются в 5-10%-ном растворе серной кислоты.
Медь и ее сплавы могут подвергаться полированию электрохимическим способом. При этом широкое распространение получили фосфорно-кислые электролиты на основе ортофосфорной кислоты * . Процесс электрополирования проходит при температуре электролита 80-85°С, напряжении 12 В и плотности тока 5-7 А/дм 2 . Время полирования 1-2 мин. После полирования изделия промывают в воде, декапируют в 5-10%-ном растворе серной кислоты, вновь промывают и высушивают.
* ( В зависимости от марки сплава меди для электрополировки применяются электролиты следующих концентраций (на 100 мл раствора): 1) ортофосфорная кислота — 60-100 г, 2) дистиллированная вода — 40-0 мл.)
Полирование цветных металлов и их сплавов, используемых в ювелирном производстве для изготовления изделий бижутерии, может производиться и химическим методом. К недостаткам этого процесса по отношению к электрохимическому полированию относится сложность составления растворов и недостаточный блеск поверхности изделия.
- Гидродинамическая прочистка канализации: решение засоров
- Служба по дезинфекции: практические решения для дома и бизнеса
- Практическое применение средств индивидуальной защиты на работе
- Преимущества гидроструйной очистки поверхностей
- Армированная полиэтиленовая пленка для теплиц — как продлить срок службы