Наиболее сильно металл коррозирует
Наиболее сильно металл коррозирует
Коррозия металлов.Сплавы

Конспект урока по химии в 9 классе
Тема урока: «Сплавы. Коррозия металлов.
При плавлении металлы обычно смешиваются, образуя сплавы. Ещё в глубокой древности люди заметили, что в большинстве случаев сплавы обладают другими, нередко более полезными для человека свойствами, чем составляющие их чистые металлы.
Компонентами сплавов могут быть и неметаллы, и соединения.
По состоянию компонентов сплавы могут быть однородными, когда при сплавлении образуется как бы раствор одного металла в другом, например сплавы меди и олова, золота и серебра, и неоднородными, например чугун, представляющий собой механическую смесь железа и углерода.
Сплавы классифицируют по-разному, в зависимости от того, какой признак взят за основу. Чаще всего сплавы подразделяют по составу. Например, выделяют медные, алюминиевые, никелевые, титановые и другие сплавы.
Есть группы сплавов, носящие общие названия: бронзы, латуни и др. Иногда в названии сплава отмечают особо ценные компоненты: бериллиевые бронзы, вольфрамовая сталь и др.
В металлургии железо и все его сплавы выделяют в одну группу под названием чёрные металлы; остальные металлы и их сплавы имеют техническое название цветные металлы.
Подавляющее большинство железных (или чёрных) сплавов содержит углерод. Их разделяют на чугуны и стали. См. учебник
Коррозия металлов
Ржавчина, которая появляется на поверхности стальных и чугунных изделий – это яркий пример коррозии.
Ежегодно из-за коррозии теряется около четверти всего произведённого в мире железа. Коррозия вызывает серьёзные экологические последствия. Утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды, что отрицательно влияет на здоровье и жизнь людей.
По механизму протекания разрушений различают 2 типа коррозии: химическую и электрохимическую.
Коррозию металлов и сплавов (их окисление) вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды). Эти компоненты непосредственно окисляют металлы – происходит химическая коррозия. Рис.43
Электрохимическая коррозия – это разрушение металлов при контакте двух металлов в воде или среде электролита. Электрохимическая коррозия распространена значительно шире, чем химическая. Рассм. рис. 44, а затем написать:
Для борьбы с коррозией существует много способов. Назовём некоторые из них.
1. Нанесение защитных покрытий на поверхности предохраняемого от коррозии металла. Для этого часто используют масляные краски, эмали, лаки.
2. Использование нержавеющих сталей, содержащих специальные добавки. Например, «нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля.
3. Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды. Такие вещества называют ингибиторами коррозии.
4. Создание контакта с более активным металлом — протектором. Например, для защиты стальных корпусов морских судов обычно используют цинк.
Задания на закрепление материала:
1. Коррозию металлов и сплавов вызывает
А) вода и кислород
Б) оксиды углерода и серы
В) растворы солей
Г) все перечисленные компоненты
2. Наиболее сильно металл коррозирует
А) в растворе хлорида натрия
Б) в кипяченой дистиллированной воде
В) в сухом воздухе
Г) в дистиллированной воде
3. Для защиты стальных корпусов морских судов обычно используют
4.Более активный металл, предотвращающий коррозию менее активного металла, называется
А) катализатор коррозии
Б) активатор коррозии
В) ингибитор коррозии
5. Вещества, введение которых уменьшает агрессивность среды, называют
А) катализаторы коррозии
Б) активаторы коррозии
В) ингибиторы коррозии
Ответы: 1Г; 2А; 3Б; 4Г; 5В
Просмотр содержимого документа
«Коррозия металлов.Сплавы»
Конспект урока по химии в 9 классе
Тема урока: «Сплавы. Коррозия металлов.
При плавлении металлы обычно смешиваются, образуя сплавы. Ещё в глубокой древности люди заметили, что в большинстве случаев сплавы обладают другими, нередко более полезными для человека свойствами, чем составляющие их чистые металлы.

Компонентами сплавов могут быть и неметаллы, и соединения.
По состоянию компонентов сплавы могут быть однородными, когда при сплавлении образуется как бы раствор одного металла в другом, например сплавы меди и олова, золота и серебра, и неоднородными, например чугун, представляющий собой механическую смесь железа и углерода.
Сплавы классифицируют по-разному, в зависимости от того, какой признак взят за основу. Чаще всего сплавы подразделяют по составу. Например, выделяют медные, алюминиевые, никелевые, титановые и другие сплавы.
Есть группы сплавов, носящие общие названия: бронзы, латуни и др. Иногда в названии сплава отмечают особо ценные компоненты: бериллиевые бронзы, вольфрамовая сталь и др.
В металлургии железо и все его сплавы выделяют в одну группу под названием чёрные металлы; остальные металлы и их сплавы имеют техническое название цветные металлы.
Подавляющее большинство железных (или чёрных) сплавов содержит углерод. Их разделяют на чугуны и стали. См. учебник
Коррозия металлов
Ржавчина, которая появляется на поверхности стальных и чугунных изделий – это яркий пример коррозии.

Ежегодно из-за коррозии теряется около четверти всего произведённого в мире железа. Коррозия вызывает серьёзные экологические последствия. Утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды, что отрицательно влияет на здоровье и жизнь людей.
По механизму протекания разрушений различают 2 типа коррозии: химическую и электрохимическую.
Коррозию металлов и сплавов (их окисление) вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды). Эти компоненты непосредственно окисляют металлы – происходит химическая коррозия. Рис.43
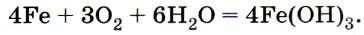
Электрохимическая коррозия – это разрушение металлов при контакте двух металлов в воде или среде электролита. Электрохимическая коррозия распространена значительно шире, чем химическая. Рассм. рис. 44, а затем написать:
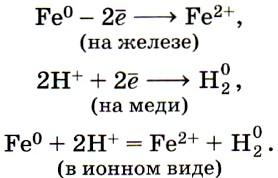
Для борьбы с коррозией существует много способов. Назовём некоторые из них.
1. Нанесение защитных покрытий на поверхности предохраняемого от коррозии металла. Для этого часто используют масляные краски, эмали, лаки.
2. Использование нержавеющих сталей, содержащих специальные добавки. Например, «нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля.
3. Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды. Такие вещества называют ингибиторами коррозии.
4. Создание контакта с более активным металлом — протектором. Например, для защиты стальных корпусов морских судов обычно используют цинк.
Задания на закрепление материала:
1. Коррозию металлов и сплавов вызывает
А) вода и кислород
Б) оксиды углерода и серы
В) растворы солей
Г) все перечисленные компоненты
2. Наиболее сильно металл коррозирует
А) в растворе хлорида натрия
Б) в кипяченой дистиллированной воде
В) в сухом воздухе
Г) в дистиллированной воде
3. Для защиты стальных корпусов морских судов обычно используют
4.Более активный металл, предотвращающий коррозию менее активного металла, называется
А) катализатор коррозии
Б) активатор коррозии
В) ингибитор коррозии
5. Вещества, введение которых уменьшает агрессивность среды, называют
Основы теории коррозии металлов и способы защиты от нее
Коррозия (от позднелатинского corrōsiōn «грызть, жевать») представляет собой постепенно развивающийся процесс поверхностного повреждения металлов, обладающих способностью активно реагировать с кислородом. Один из наглядных примеров этого явления – коррозия металла из-за образования оксида железа Fe2O3 или ржавчины.
- Определение коррозии
- Виды коррозии металлов
- Химическая
- Методы защиты от коррозии
- Металлические покрытия
- Неметаллические покрытия
- Химические покрытия
- Изменение состава технического металла и коррозионной среды
- Электрохимическая защита
Коррозия (от позднелатинского corrōsiōn «грызть, жевать») представляет собой постепенно развивающийся процесс поверхностного повреждения металлов, обладающих способностью активно реагировать с кислородом. Один из наглядных примеров этого явления – коррозия металла из-за образования оксида железа Fe2O3 или ржавчины. Характерно, что два остальных окисла железа – закись FeO и закись-окись Fe3O4 — обладают значительно меньшей корродирующей способностью, причём Fe3O4 при некоторых условиях может даже играть роль твёрдой смазки.
Теория коррозии предполагает, что для начала разрушения металла необходимо наличие четырёх основных компонентов:
Электрического соединения, которое существует между катодом и анодом.
Электролита или любой другой токопроводящей среды, облегчающей направленное перемещение ионов.
Обычное образование ржавчины на стали можно рассматривать как электрическую батарейку. Когда атомы металлов подвергаются воздействию окружающей среды, которая содержит кислород, металл производит электроны. Это действие можно локально ограничить, чтобы создать трещину или микроуглубление. С развитием процесса коррозия распространяется на прилегающую территорию, что приведет к общему ухудшению состояния поверхности. Ограниченная (точечная) коррозия способна вызвать усталость металла – снижение его прочностных характеристик, а имеющиеся коррозионные агенты, например, морская вода, могут привести к прогрессирующему росту трещины.
Теория коррозии утверждает также, что интенсификации поверхностного разрушения металла способствуют микроструктурные изменения, возникающие при повышенных температурах, в частности, при сварке. Это объясняется повышенными значениями энергии активации, из-за чего количество ионов, проводящих электрический ток, лавинообразно возрастает.
Определение коррозии
Коррозия — это постепенное разрушение объектов, обычно металлов, вызванное активной окружающей средой-электролитом и химической реакцией окисления.
Суть коррозионного процесса – наличие постоянно действующей анодной реакции. Она вызывается за счёт растворения металла, который генерирует электроны. Часть энергии активации дополнительно расходуется на другой процесс, называемый катодной реакцией. Эти два процесса уравновешивают произведенные заряды. Зоны, вызывающие эти процессы, могут быть расположены близко или далеко друг от друга, в зависимости от ситуации.
Электроны, генерируемые в процессе, должны потребляться посредством катодной реакции. Ионы водорода и электроны вступают в реакцию с образованием атомарного, а затем и газообразного водорода. Однако водород является сильнейшим восстановителем, поэтому дальнейшую коррозию можно предотвратить, создав на поверхности металла тонкую газовую плёнку. Она служит поляризатором, уменьшающим контакт металла с водой и уменьшающим коррозию. Таким образом, всё, что разрушает барьерную плёнку, увеличивает скорость коррозии.
Основными факторами, определяющими интенсивность процесса, являются:
Уровень возникающих механических и термических напряжений;
Характер протекающих химических реакций.
Коррозия сдерживает внедрение в производство новых металлических материалов и причиняет значительный ущерб экономике.
Виды коррозии металлов
Классификация всех коррозионных явлений может быть произведена по следующим параметрам:
По степени равномерности. Различают поверхностную коррозию, которая равномерно уменьшает толщину поверхности, и неравномерную коррозию – точечную или язвенную;
По интенсивности воздействия на металл. Например, избирательная коррозия разрушает только определённые структурные составляющие, а контактная воздействует на менее коррозионно стойкие («неблагородные») составляющие пар трения;
При межкристаллитной коррозии разрушение происходит по границам зёрен и распространяется вглубь металла.
Фреттинг-коррозия, когда два контактирующих между собой тела совершают относительно друг друга колебательные движения малой амплитуды (не более 100 мкм).
При одновременном воздействии растягивающих напряжений и агрессивной среды наблюдается коррозионное растрескивание межкристаллитного или транскристаллитного характера, а при наложении знакопеременных напряжений начинается коррозионно-усталостное разрушение. Защита металлов от коррозии, таким образом, предполагает также и одновременное уменьшение износа деталей.
Далее рассматриваются основные явления, которые происходят в повреждающихся зонах при различных видах коррозии.
Химическая
Химическая коррозия относится к постепенному разрушению поверхности металла из-за реакции поверхности с веществами во внешней среде. Она происходит в результате окисления металла кислотами с образованием оксидов.
Высокотемпературный вариант заключается в воздействии на металл сухих газов. Все металлы в сухом воздухе покрыты очень тонким (2…10 мкм) слоем оксидов. Этот слой образуется при очень высоких температурах, когда реакция с кислородом воздуха идёт без каких-либо ограничений. При комнатной температуре реакция останавливается, поскольку оксидная плёнка становится слишком тонкой. В случае, например, с алюминием, такая плёнка, состоящая из оксида Al2O3, эффективно защищает поверхность алюминиевой посуды, поскольку коррозионная стойкость чистого алюминия невысока.
Химическая коррозия начинается в месте, где металл находится под давлением и изолирован от циркуляции воздуха. Это побуждает ионы металлов растворяться во влажной среде, что в конечном итоге ускоряет реакцию между ними и водой. В результате реакции образуются водные оксиды (известные при взаимодействии с железом как ржавчина) и свободные ионы.
Электрохимическая
Для моделирования процесса необходимо рассмотреть железную пластину, покрытую любым электропроводящим покрытием, например, оксидной окалиной, которая образовалась во время высокотемпературной обработки. При погружении пластины в раствор хлорида натрия, обнаруживается, что, если повредить целостность окалины, в этом месте ржавление железа пойдёт значительно быстрее. Электрохимическая коррозия наиболее достоверно объясняет ржавление железа в аэробных условиях.
Теория электрохимической коррозии предполагает наличие дополнительных химических реакций:
Fe → Fe ++ + 2e−, — анодная реакция;
2e− + O + H2O → 2OH− — катодная реакция.
Когда ионы металла растворяются, их заряд уравновешивается ионами хлорида, которые мигрируют в область атаки, притягиваясь образующимися ионами положительного заряда. Хлорид железа растворяется в воде, но это не создаёт препятствий для дальнейшей коррозии, поскольку раствор хлорида железа вследствие гидролиза очень кислый. По мере того, как ионы Fe ++ удаляются из этого места, они сталкиваются с гидроксильными ионами, которые либо присутствуют в воде естественным образом, либо образуются в результате катодной реакции. Результатом является образование и осаждение гидроксида железа Fe (OH)2. Далее, в присутствии растворённого кислорода, он быстро окисляется до оксигидроксида железа FeOOH.
Таким образом, при электрохимической коррозии происходят три реакции, причём в трёх разных местах. Анодная происходит в зонах потери металла, катодная – там, где растворённый в воде кислород может принимать электроны, а сама твёрдая окалина формируется в местах механических повреждений на поверхности изделия.
В последнее время выделяют ещё один вид коррозии – механохимическую, которая происходит в результате динамического взаимодействия контактирующих элементов окружающей среды в условиях высоких контактных давлений.
Методы защиты от коррозии
Ржавчина и другие коррозионные проявления могут приводить к проблемам с безопасностью, нарушать целостность производственного оборудования и расходных материалов. Даже плановое техническое обслуживание по удалению и устранению ржавчины увеличивает эксплуатационные затрат. Отработано ряд способов, используя которые, можно минимизировать коррозию.
Металлические покрытия
Эти методы предотвращения коррозии заключаются в погружении стали в расплав металла, электрический потенциал которого меньше, чем железа (чем больше разница, тем эффективнее покрытие).
Практическое применение находят гальванические покрытия цинком или оловом, а также диффузионные покрытия никелем, хромом, кремнием или алюминием. По сравнению с другими методами защиты от коррозии гальванизация известна более низкими начальными затратами, устойчивостью и универсальностью.
Поскольку расход металла-протектора довольно велик, преимущество получают технологии, отличающиеся экономичностью используемых компонентов и прочностью создаваемых покрытий. Первым в этом списке находится цинкование. Железо в стали вступает в реакцию с цинком, образуя прочное покрытие из сплава, которое служит защитой.
Неметаллические покрытия
Один из самых простых способов предотвратить коррозию — использовать защитные покрытия из неметаллов — краски, пластика, воска или порошка. Порошки, включая эпоксидную смолу, нейлон и уретан, наносятся на металлическую поверхность и нагреваются до стадии расплавления, образуя тонкую плёнку.
Краска действует как покрытие, защищающее металлическую поверхность от электрохимического заряда, который исходит от коррозионно опасных соединений. Обычно используют комбинацию различных слоёв краски, которые выполняют разные функции. Грунтовка действует как ингибитор, промежуточный слой увеличивает общую толщину краски, а финишный слой обеспечивает устойчивость к факторам окружающей среды.
Химические покрытия
Относятся к методам временной антикоррозионной защиты стали, например, во время пластического деформирования при повышенных температурах. Наибольшее распространение получили технологии фосфатирования и оксалатирования.
При фосфатировании поверхность покрывают сплошным слоем фосфатных солей железа и марганца, а при оксалатировании – водорастворимыми солями щавелевой кислоты. Фосфатирование используется для обработки нелегированных сталей, оксалатирование – легированных. Покрытие прочно сцепляется с поверхностью, способствуя снижению трения и уменьшению износа инструмента. После окончания штамповки покрытие удаляют.
Изменение состава технического металла и коррозионной среды
Заключается в специальном легировании стали элементами, повышающими её коррозионную стойкость. Если это возможно, то в механическую систему, которая работает в условиях повышенной температуры и влажности, вводят смазку, содержащую противокоррозионные компоненты (восстановители).
Элементом, который положительно влияет на коррозионную стойкость стали, является хром. Для реализации этого эффекта сталь должна содержать не менее 13% хрома. Каждые дополнительные 5% хрома обеспечивают еще лучшую коррозионную стойкость.
Никель — второй важный элемент для улучшения коррозионной стойкости стали, причём добавка никеля приводит также к стабилизации аустенита. Третьим важным элементом повышения коррозионной стойкости является молибден. Однако его добавки повышают коррозионную стойкость только нержавеющих сталей с достаточным содержанием хрома и никеля.
Электрохимическая защита
Процесс коррозии, которая возникает при контакте двух разных металлов, находящихся в электролите, можно остановить использованием системы катодной защиты. Для реализации метода активные центры на поверхности металла необходимо преобразовать в пассивные путем предоставления электронов из другого источника (обычно используют аноды, прикрепленные к поверхности). Металлы, используемые для анодов — алюминий, магний или цинк.
Катодная защита очень эффективна в бытовой технике, однако аноды необходимо часто проверять, что увеличивает расходы на техническое обслуживание.
Коррозия металлов и способы защиты от нее
| Коррозия – это процесс разрушения металлов и металлических конструкций под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе. |
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
- Благородные металлы не подвергаются коррозии из-за химической инертности.
- Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии.
- Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
| Химическая коррозия сопровождается химическими реакциями. Как правило, химическая коррозия металлов происходит при действии на металл сухих газов, её также называют газовой. |
При химической коррозии также возможны процессы:
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Как правило, такие процессы протекают в аппаратах химических производств.
| Электрохимическая коррозия – это процесс разрушения металла, который сопровождается электрохимическими процессами. Как правило, электрохимическая коррозия протекает в присутствии воды и кислорода, либо в растворах электролитов. |
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к олову, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe –2e = Fe 2+
На поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
2H + + 2e → H2
O2 + 2H2O + 4e → 4OH –
| Например, при контакте железа с оловом в растворе соляной кислоты происходят процессы: |
Анод: Fe –2e → Fe 2+
Катод: 2H + + 2e → H2
Суммарная реакция: Fe + 2H + → H2 + Fe 2+
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: O2 + 2H2O + 4e → 4OH –
Суммарная реакция:
Fe 2+ + 2OH – → Fe(OH)2
4Fe(OH)2 + O2+ 2H2O → 4Fe(OH)3
При этом образуется ржавчина.
Методы защиты от коррозии
Защитные покрытия
Защитные покрытия предотвращают контакт поверхности металла с окислителями.
- Катодное покрытие – покрытие менее активным металлом (защищает металл только неповреждённое покрытие).
- Покрытие краской, лаками, смазками.
- Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте).
Создание сплавов, стойких к коррозии
Физические свойства сплавов могут существенно отличаться от свойств чистых металлов. Добавление некоторых металлов может приводить к повышению коррозионной стойкости сплава. Например, нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью.
Изменение состава среды
Коррозия замедляется при добавлении в среду, окружающую металлическую конструкцию, ингибиторов коррозии. Ингибиторы коррозии — это вещества, подавляющие процессы коррозии.
Электрохимические методы защиты
Протекторная защита: при присоединении к металлической конструкции пластинок из более активного металла – протектора. В результате идёт разрушение протектора, а металлическая конструкция при этом не разрушается.
Коррозия металлов
Коррозия – рыжая крыса,
Грызет металлический лом.
В.Шефнер
Металл служит примером прочности. Недаром, когда хотят подчеркнуть это свойство, говорят: «Прочный как сталь». С понятием «металл» связано представление о чем-то неизменном, прочном, твердом. Но это не всегда так. Под влиянием внешней среды металлы окисляются и в результате разрушаются. Это и называется коррозией.
Какова же причина разрушения металлов? Все они, за исключением золота, серебра и платины, встречаются в природе в виде соединений, которые образуют минералы и горные породы. Существование металлов в свободном состоянии энергетически менее выгодно. Чтобы получить их в чистом виде, необходимо затратить энергию, в основном тепловую. Из естественного природного состояния их переводят в металлическое. Металлы, корродируя, возвращаются в энергетически выгодное состояние оксидов (рис. 1).
Рис. 1.
Схема изменения энергии при получении металлов и при коррозии
Коррозия бывает двух видов: химическая и электрохимическая.
Химическая коррозия
Кислород воздуха взаимодействует с поверхностным слоем металла, при этом образуется оксидная пленка. Она образуется в условиях сухого воздуха и при комнатной температуре, и при нагревании. Такую коррозию называют химической. Пленка может быть прочной и препятствовать дальнейшему процессу коррозии. Такие прочные пленки образуются на поверхности алюминия и цинка. Но есть и рыхлые пленки, которые не предохраняют металл от разрушения, как, например, у оксидов щелочных металлов. Так, поверхность только что отрезанного кусочка натрия на глазах мутнеет, образуется рыхлая, с трещинами пленка, свободно пропускающая к поверхности металла кислород воздуха, а также другие газы и пары воды.
Быстрое окисление на воздухе металлического натрия или кальция – пример химической коррозии.
Проведем опыт по исследованию пленок. Очистим поверхность металлической пластинки и начнем нагревать. Постепенно на поверхности появляются так называемые цвета побежалости, т. е. поверхность пластинки окрашивается во все цвета радуги. Это появляются пленки различной толщины, они по-разному преломляют свет.
Протекающие при химической коррозии окислительно-восстановительные процессы осуществляются путем непосредственного перехода электронов на окислитель. Примерами химической коррозии являются реакции металлов с кислородом, хлором, оксидами серы.
В результате такой коррозии сильно разрушаются многие важные детали инженерных конструкций (газовые турбины, сопла ракетных двигателей, арматура печей и т. д.).
Электрохимическая коррозия
Этот вид коррозии проходит в среде, проводящей электрический ток.
Многие металлические предметы, которые мы используем в быту, не подвергаются видимой коррозии, в то время как потерянный ключ быстро ржавеет. Следовательно, электрохимическая коррозия зависит от внешних условий (состава и концентрации электролита). Скорость разрушения разных металлов различна.
Электрохимическая коррозия наблюдается и в том случае, когда контактируют металлы, находящиеся в ряду напряжений на некотором расстоянии друг от друга. Так, если при изготовлении изделия из листового железа используют медные заклепки, то в присутствии влаги они будут играть роль катода, а железный лист станет анодом и, следовательно, будет разрушаться.
Коррозионное разрушение металла в растворах электролитов можно рассматривать как результат работы большого количества микроскопических гальванических элементов, у которых катодами служат посторонние примеси в металле, а анодом сам металл.
Для работы гальванического элемента необходимо наличие двух металлов различной химической активности и среды, проводящей электрический ток, – электролита. При этом сила проявляющегося тока тем больше, чем дальше стоят металлы в ряду напряжений друг от друга. Поток электронов идет от более активного металла к менее активному, являющемуся катодом. В этих случаях химическая энергия окислительно-восстановительных процессов гальванического элемента переходит в электрическую.
Примеры коррозии
1. Консервная банка (луженое железо) представляет собой гальваническую пару железо–олово. Пока банка герметически закрыта, контактная пара не находится в среде, проводящей электрический ток, и банка может не подвергаться коррозии длительное время. Известен случай, когда консервная банка пролежала в земле около ста лет и не подверглась коррозии. Но стоит банку вскрыть, как незамедлительно начинается всепожирающий процесс коррозии. При этом электроны от железа, как более активного металла, переходят на олово. Между поверхностью оловянного покрытия и раствором возникает разность потенциалов. Ионы водорода из воды или кислоты собираются на поверхности малоактивного металла, где восстанавливаются с помощью электронов, идущих от растворяющегося железа. Чем более кислый раствор, тем коррозия интенсивней. В этом случае «работает» гальванический элемент. Железо служит растворимым анодом, а олово – катодом:
анод: Fe 0 – 2e = Fe 2+ ,
катод: 2Н + + 2e = Н2.
Ржавление железа – сложный процесс, в результате которого на поверхности образуется ржавчина. Упрощенный состав ржавчины, рыхлой массы красно-коричневого цвета, – гидроксид железа(III):
Fe 2+ + 2OH – = Fe(OH)2 ,
,
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 .
.
2. Основа оцинкованного ведра – железо, поверхность – серебристо-белый блестящий металл. По мере использования поверхность ведра покрывается буровато-беловатыми пятнами, разводами. Цинк в данной гальванической паре, как более активный металл, будет являться анодом и в присутствии среды, проводящей электрический ток, будет разрушаться, железо же не ржавеет. Поэтому оцинкованные ведра сравнительно недороги и служат долго.
Состав бело-бурых пятен – в основном гидроксид цинка. Химизм процесса:
анод: Zn 0 – 2e = Zn 2+ ,
катод: 2Н + + 2e = Н2.
Zn 2+ + 2OH – = Zn(OH)2
.
«Стригущий лишай цинковых покрытий» – это картина одного из видов коррозии цинка, внешне очень похожая на известное грибковое заболевание. Замечено, что в помещениях цинк корродирует быстрее, чем на открытой ветрам и дождям оцинкованной крыше. Происходит это потому, что продукты коррозии (оксид, гидроксид и карбонат цинка) не смываются дождями. Образовавшиеся отложения «белой ржавчины» впитывают влагу, и на оцинкованной поверхности разрастаются светлые пятна.
Интересно еще одно обстоятельство: мягкая вода вызывает более сильную коррозию этого металла, чем вода, содержащая в большом количестве соли жесткости. Жесткая вода действует менее агрессивно, т. к. осадок карбонатов образует на цинковой поверхности довольно прочное защитное покрытие.
Исходя из положения элемента в периодической системе, можно заранее сказать, какими химическими, а следовательно, и коррозионными свойствами он обладает. Под термином «коррозионные свойства» понимается, как легко данный элемент окисляется, какова устойчивость образующихся оксидов по отношению к воде, растворам солей и различных газов.
Так, в I группе в побочной подгруппе расположены металлы, весьма стойкие в коррозионном отношении. Это медь, серебро, золото, причем их коррозионная стойкость повышается с увеличением атомной массы.
Во II группе также более устойчивы металлы побочной подгруппы: цинк, кадмий, ртуть. На их поверхности в присутствии кислорода образуется тонкая, довольно прочная пленка оксидов, предохраняющая от дальнейшего процесса разрушения.
В III группе из технически важных металлов находится алюминий – это химически активный металл. Он легко окисляется кислородом воздуха, вследствие чего на его поверхности образуется тонкая стекловидная пленка. Но эта пленка обладает высокими защитными свойствами.
В IV группе находятся коррозионностойкие металлы – олово, свинец, стойкость которых тоже объясняется образованием прочных защитных пленок.
Металлы, находящиеся в четных рядах больших периодов, в V, VI и VII группах, обладают высокой способностью к пассивации, а следовательно, большой коррозийной стойкостью. Это ванадий, хром, кобальт и др.
Наиболее коррозионностойкие металлы находятся в VIII группе, причем чем больше их атомная масса, тем больше их устойчивость. Следовательно, из металлов VIII группы наиболее коррозионностойкие осмий, иридий и платина.
Коррозия приводит к техногенному засорению нашей планеты. В настоящее время на земном шаре ежегодно выплавляется более 0,7 млрд т стали, а уничтожается коррозией от 10 до 25% этой величины. Средняя продолжительность жизни стальных изделий составляет около 15 лет. Таков же средний возраст изделий из многих цветных и черных металлов.
Знаменитая Эйфелева башня (7,3 тыс. т металлических конструкций) давно была бы уничтожена коррозией, если бы каждые 7 лет ее не покрывали краской. На окраску уже затрачены средства, превышающие стоимость самого сооружения.
Коррозия, подобно ненасытному дракону, сжирает миллиарды тонн железа и приносит громадный ущерб во всех странах. Никакие предохранительные покрытия, смазки, лаки, краски, использование сплавов не могут предотвратить болезни металлов – окисление, распыление, ржавление.
Все применяемые методы защиты металлов можно разделить на три группы:
Статья подготовлена при поддержке компании ООО «ВторМеталл Плюс». Если вам нужно избавиться от чугунной ванны или прочего металлолома, то оптимальным решением станет обратиться в компанию «ВторМеталл Плюс». На сайте, расположенном по адресу «www.Vivoz-Loma.Ru», вы сможете, не отходя от экрана монитора, узнать, где расположены пункты приема металлолома, а также заказать демонтаж и вывоз металлолома. В компании «ВторМеталл Плюс» работают только высококвалифицированные специалисты, которые в кратчайшие сроки произведут требуемые работы по демонтажу и вывозу металлолома.
1) различные покрытия;
2) обработка среды, в которой металлы находятся;
3) электрохимические методы защиты.
Опыт.
В U-образную трубку наливают до половины ее объема раствор поваренной соли. В каждое колено трубки добавляют несколько капель фенолфталеина. В одно колено трубки погружают предварительно очищенную медную пластинку, а в другое – цинковую.
Обе пластинки соединяют медной проволокой (рис. 2). Вскоре в колене с медной пластинкой наблюдается сначала розовое, а затем малиновое окрашивание, что указывает на появление избыточных свободных гидроксидных групп (ОН – ).
Рис. 2.
Медно-цинковый
гальванический элемент
В этом опыте при соединении проволокой цинковой пластинки с медной избыточные электроны, образующиеся вследствие перехода цинка в виде ионов в раствор, перетекают с цинковой пластинки на медную. Возникает гальванический элемент. С медной пластинки электроны переходят на ионы водорода. В растворе образуется избыток гидроксид-ионов, которые и дают щелочную реакцию. Иными словами, происходит окислительно-восстановительная реакция, в результате которой возникает электрический ток. Поток электронов движется от цинка (анода) к меди (катоду). Цинк окисляется (растворяется), а на меди наблюдается восстановление ионов водорода (видны пузырьки).
Наиболее сильно металл коррозирует

Рис. 3.5. Схема развития коррозии:
а — на анодном (цинковом) покрытии; б — на катодном (никелевом) покрытии; 1результат коррозии; 2 — влага; 3, 5 — цинковое и никелевое покрытия; 4 — стальное изделие
Разные металлы и сплавы имеют неодинаковое сопротивление коррозии. Так, натрий, калий, литий совершенно коррозионно не устойчивы даже в обычных условиях и поэтому не пригодны для использования в технике. В то же время хром, никель, алюминий, молибден, кобальт и другие металлы довольно трудно корродируют. Железо, никель, магний, кадмий стойки против действия щелочей и разрушаются в кислотах, а алюминий, цинк и свинец не разрушаются в нейтральных средах, но подвержены воздействию кислот и щелочей.
Наиболее опасна местная коррозия, которая не всегда заметна и часто является причиной разрушения деталей еще и от механических нагрузок (коррозионная усталость). К тому же многие способы защиты изделий от коррозии пригодны для одних условий и не пригодны для других. В этой связи важно, прежде чем приступить к защите от коррозии, установить причину и условия ее возникновения, форму и размеры защищаемых изделий, а также экономическую целесообразность. Основные способы защиты от коррозии следующие: получение коррозионно-стойких материалов; выращивание оксидных пленок на поверхности металлов; нанесение металлических покрытий; использование протекторов; применение неметаллических покрытий.
Создание коррозионно-стойких материалов осуществляется в процессе их производства введением специальных легирующих элементов (хрома, никеля, марганца и др.), которые повышают сопротивление металла разрушению.
Выращивание оксидных пленок широко используют в технике при изготовлении изделий из стали, алюминия и других материалов. При этом используют два основных способа — оксидирование (травление в сильных оксидных средах) и анодирование (анодная обработка в оксидных средах). При оксидировании поверхность углеродистых сталей покрывается слоем оксида железа толщиной 1. 10 мкм темного (черного) цвета, защищающим металл в атмосферных условиях при низкой влажности. Воронить (оксидировать) сталь можно также нагреванием ее до темного цвета побежалости, при появлении которого его фиксируют охлаждением в масле.
Анодируют в основном алюминий и его сплавы путем образования оксидных пленок толщиной 5. 25 мкм, которые защищают металл от коррозии, обладают электроизоляционными свойствами и служат хорошим подслоем для лакокрасочных покрытий. Более высокую стойкость от коррозии дает пленка, полученная фосфатиро-ванием и состоящая из фосфорно-кислых солей марганца и железа.
Нанесение металлических покрытий на защищаемый материал выполняется несколькими методами: погружением в расплав, гальваническим покрытием, диффузионным способом, плакированием (нанесение на один металл другого, как правило, в процессе прокатки).
Методом погружения металлических изделий в расплав цинка, олова, свинца или алюминия, как правило, защищают материалы, для которых температурные воздействия не имеют значения. Этот метод высокопроизводительный, но не позволяет получать
равномерное заданной толщины покрытие но всему изделию. Гальванический метод защиты от коррозии металлов широко используют в технике, получая при этом мелкозернистые беспористые покрытия разными материалами толщиной 5. 30 мкм, имеющие хорошую адгезию с поверхностью как сырых (незакаленных), так и закаленных изделий. Такие покрытия могут быть защитными, декоративными, восстановительными. Например, цинк, кадмий и никель служат защитными покрытиями, а никель, хром, серебро и золото — декоративными. Покрытие твердым хромом значительно повышает твердость и износостойкость деталей, работающих на истирание. Нарастив значительный слой хрома (до 500 мкм), восстанавливают изношенные рабочие поверхности изделий.
Диффузионный способ — способ поверхностного насыщения нагретых основных металлов цинком, алюминием или хромом, которые могут быть в твердой или газовой фазах. Алюминием покрывают стальные детали. работающие при высоких (до I 100 °С) температурах. Кроме того, алитирование (алюминирование) уменьшает «схватывание» контактирующих изделий при их работе в вакууме, повышает износостойкость, защищает от коррозии в средах, содержащих серу, азот и углерод.
Плакирование заключается в совместном нагреве основного металла и используемого в качестве защитного, который накладывают на защищаемый, а затем одновременно прокатывают. В результате получают биметаллы и триметаллы. Так. железо можно защитить тонким слоем меди, нержавеющей стали, алюминия, которые повысят стойкость основного металла против коррозии. Этот метод используют не только как защитный. Например, в производстве полупроводниковых приборов никелевую ленту плакируют полоской золота, к которой после изготовления из нее выводных рамок, присоединяют кристаллы и электродные выводы, получая при этом значительную экономию драгоценного металла.
Протекторы используют для защиты от разрушения металлических конструкций (корпуса судов, насосы, трубопроводы и др.), находящихся в воде. Защитным металлом, как правило, служит цинк, который, сам разрушаясь, сохраняет от коррозии основной металл (анодное разрушение).
Цинкование является самым распространенным и наиболее эффективным покрытием стальных изделий. Это объясняется тем, что цинк, обладая более отрицательным нормальным потенциалом, чем железо, в атмосферных условиях корродирует и разрушается раньше защищаемого металла. В данном случае анодом является цинковое покрытие, а катодом — например, листовая сталь.
Толщина цинкования зависит от условий эксплуатации и находится в интервале 3. 30 мкм, а средняя скорость разрушения покрытия составляет 1,0. 1,5 мкм в год.
Лужение (оловянирование) обеспечивает защитный слой, довольно стойкий к влажному воздуху, но в щелочах и кислотах он растворяется. По отношению к железу олово является катодным покрытием и поэтому защищает его только механически и то при отсутствии пор. Относительно меди и ее сплавов олово служит анодом и поэтому способно быть защитным покрытием. Толщина покрытия оловом определяется назначением и находится в интервале 1,5. 8,0 мкм.
Кадмирование от цинкования отличается прежде всего повышенной стойкостью против воздействия атмосферы, насыщенной морскими испарениями, и собственно морской воды. Кроме того, кадмий более стоек в кислых растворах и нерастворим в щелочах. Толщина покрытия обычно составляет 9. 45 мкм и определяется условиями эксплуатации.
Неметаллические покрытия (лаки, краски, эмали) — самые распространенные покрытия, предохраняющие изделия от атмосферных воздействий. Их действие основано на образовании пленки из органического вещества и пигмента, нанесенных на поверхность металла в виде одного или нескольких слоев, которые после высыхания образуют непрерывные защитные и декоративные покрытия.
Эмалевые покрытия — это стекловидные пленки, которые образуются в результате сплавления при высоких температурах неметаллических порошков на основе диоксида кремния. Такие покрытия просты в употреблении и недороги, но недолговечны, так как под воздействием влаги и температуры они постепенно разрушаются.
К этому виду неметаллических покрытий относятся, например, напыленные на металл пластмассы (полиэтилен) или нанесенный слой суспензии фторопласта, подвергнутого термической обработке (30 мин при 90 °С, а затем 1 ч при 360 °С). Металл можно также гуммировать (покрывать резиной).
Кроме рассмотренных способов защиты широкое применение в производстве получило фосфатирование.
фосфатирование — это процесс создания защитной пленки фосфата (нерастворимых и воде фосфорно-кислых соединений) на поверхностях стали, чугуна под действием препарата «Мажеф». Свое название препарат получил по начальным буквам его компонентов — марганца, железа и фосфорной кислоты.
Фосфатирование является одним из самых простых, экономичных и надежных способов массовой защиты деталей из углеродистых и низколегированных марок стали и чугуна, а также цветных металлов — алюминия, цинка, магния и др. Толщина фосфатной пленки может быть в пределах от 7. 8 до 40. 50 мкм в зависимости от вида механической обработки изделия, способа подготовки к покрытию и режима фосфатирования.
Фосфатная пленка обладает следующими достоинствами: прочно сцепляется с металлом, образует пористую структуру, надежна как электроизолятор, не смачивается расплавленными металлами, коррозионно-стойка во всех видах горючих, смазочных и органических масел, в бензоле, толуоле и во всех газах, кроме сероводорода. Однако это покрытие нестойко в щелочах, кислотах, морской воде и водяном паре. Но этот недостаток может быть устранен, если фосфатное покрытие пропитать смазочными маслами или лаками.
Доброкачественная фосфатная пленка в 8—10 раз повышает коррозионную стойкость лакокрасочных покрытий, нанесенных на фосфатный грунт.
1. Какие материалы называют конструкционными?
2. Какие металлы называют сталями и чугунами?
3. Как разделяют стали и чугуны?
4. Что означает легированный металл?
5. Какие металлы называют бронзами и латунями?
6. Чем бронза отличается от латуни?
7. Какие металлы страдают «сезонной болезнью»?
8. Какие металлы называют легкими?
9. Как характеризуются алюминиевые и бериллиевые сплавы?
10. Что такое удельная прочность?
11. Для каких целей применяют алюминиевые, бериллиевые и магниевые сплавы?
12. Какие свойства придают стали сера и фосфор?
13. От чего изнашиваются металлические материалы?
Коррозия металлов и её виды
Химические и физико-химические реакции, возникающие в момент взаимодействия окружающей среды с металлами и сплавами, в большинстве случаев приводят к их самопроизвольному разрушению. Процесс саморазрушения имеет собственный термин – «коррозия». Результатом коррозии является существенное ухудшение свойств металла, вследствие чего изделия из него быстро выходят из строя. Каждый металл обладает свойствами, позволяющими ему сопротивляться разрушению. Коррозийная стойкость или, как ее еще называют, химическое сопротивление материала, является одним из главных критериев, по которым осуществляется отбор металлов и сплавов для изготовления тех или иных изделий.
 В зависимости от интенсивности и длительности коррозийного процесса металл может быть подвергнут как частичному, так и полному разрушению. Взаимодействие коррозийной среды и металла приводят к образованию на поверхности металла таких явлений, как окалина, оксидная пленка и ржавчина. Данные явления отличаются друг от друга не только внешним видом, но еще и степенью адгезии с поверхностью металлов. Так, например, в процессе окисления такого металла, как алюминий, его поверхность покрывает пленка оксидов, отличающаяся высокой прочностью. Благодаря этой пленке разрушительные процессы купируются и не проникают вовнутрь. Если говорить о ржавчине, то результатом ее воздействия является образование рыхлого слоя. Процесс коррозии в данном случае очень быстро проникает во внутреннюю структуру металла, что способствует его скорейшему разрушению.
В зависимости от интенсивности и длительности коррозийного процесса металл может быть подвергнут как частичному, так и полному разрушению. Взаимодействие коррозийной среды и металла приводят к образованию на поверхности металла таких явлений, как окалина, оксидная пленка и ржавчина. Данные явления отличаются друг от друга не только внешним видом, но еще и степенью адгезии с поверхностью металлов. Так, например, в процессе окисления такого металла, как алюминий, его поверхность покрывает пленка оксидов, отличающаяся высокой прочностью. Благодаря этой пленке разрушительные процессы купируются и не проникают вовнутрь. Если говорить о ржавчине, то результатом ее воздействия является образование рыхлого слоя. Процесс коррозии в данном случае очень быстро проникает во внутреннюю структуру металла, что способствует его скорейшему разрушению.
Показатели, по которым осуществляется классификация коррозийных процессов:
- вид коррозийной среды;
- условия и механизм протекания;
- характер коррозийных разрушений;
- вид дополнительных воздействий на металл.
По механизму коррозийного процесса различают как химическую, так и электрохимическую коррозию металлов и сплавов.
Химическая коррозия – это взаимодействие металлов с коррозийной средой, в процессе которого наблюдается единовременное осуществление окисления металла и восстановление окислительного компонента среды. Взаимодействующие между собой продукты не разделены пространственно.
Электрохимическая коррозия – это взаимодействие металлов с коррозийно-активной средой, представляющей собой раствор электролита. Процесс ионизации атомов металла, а также процесс восстановления окислительного компонента данной коррозийной среды протекают в разных актах. Электродный потенциал раствора электролита оказывает существенное влияние на скорость этих процессов.
В зависимости от типа агрессивной среды существует несколько видов коррозии
 Атмосферная коррозия представляет собой саморазрушение металлов в воздушной атмосфере, либо в газовой атмосфере, отличающейся повышенной влажностью.
Атмосферная коррозия представляет собой саморазрушение металлов в воздушной атмосфере, либо в газовой атмосфере, отличающейся повышенной влажностью.
Газовая коррозия – это коррозия металлов, происходящая в газовой среде, содержание влаги в которой минимально. Отсутствие влаги в газовой среде не единственное условие, способствующее саморазрушению металла. Также коррозия возможна и при высоких температурах. Наиболее часто встречается данный вид коррозии в нефтехимической и химической промышленности.
Радиационная коррозия представляет собой саморазрушение металла под воздействием на него радиоактивного излучения разной степени интенсивности.
Подземная коррозия – это коррозия, происходящая в почвах и различных грунтах.
Контактная коррозия представляет вид коррозии, образованию которого способствует контакт нескольких металлов, отличающихся друг от друга стационарными потенциалами в конкретном электролите.
Биокоррозия – это коррозия металлов, происходящая под воздействием различных микроорганизмов и их жизнедеятельности.
Коррозия током (внешним и блуждающим) – еще один вид коррозии металлов. Если на металл воздействует ток от внешнего источника, то это коррозия внешним током. Если же воздействие осуществляется посредством блуждающего тока, то это коррозия блуждающего тока.
Коррозийная кавитация представляет собой процесс саморазрушения металлов, возникновению которого способствует как ударное, так и коррозионное воздействие внешней среды.
Коррозия под напряжением представляет собой коррозию металла, причиной появления которой является взаимодействие коррозийно-активной среды и напряжений механического типа. Данный вид коррозии представляет существенную опасность для конструкций из металла, которые подвергаются сильнейшим механическим нагрузкам.
Фреттинг-коррозия — вид коррозии металлов, к которой приводит совокупность вибрации и воздействие коррозийной среды. Чтобы минимизировать вероятность возникновения коррозии при трении и вибрации, необходимо внимательно подходить к выбору конструкционного материала. Также необходимо применять специальные покрытия и по возможности снизить коэффициент трения.
По характеру разрушений коррозия разделяется на сплошную и избирательную
Сплошная коррозия полностью покрывает поверхность металла. Если скорость разрушений на всей поверхности одинакова, то это равномерная коррозия. Если разрушение металла на различных его участках происходит с разной скоростью, то коррозия называется неравномерной.
Избирательная коррозия подразумевает разрушение одного из компонентов сплава или же одной структурной составляющей.
Местная коррозия, проявляющаяся в виде отдельно разбросанных по поверхности металла пятен, представляет собой углубления разной толщины. Разрушения могут представлять собой раковины или точки.
Подповерхностная коррозия образуется непосредственно на поверхности металла, после чего активно проникает вглубь. Данный вид коррозии сопровождается расслоением изделий из металла.
Межкристаллитная коррозия проявляется в разрушении металла по границам зерен. По внешнему виду металла ее достаточно сложно определить. Однако очень быстро меняются показатели прочности и пластичности металла. Изделия из него становятся хрупкими. Наиболее опасен этот вид коррозии для хромистых и хромоникелевых видов стали, а также для алюминиевых и никелевых сплавов.
Щелевая коррозия образуется на тех участках металлов и сплавов, которые находятся в резьбовых креплениях, различных зазорах и под всевозможными прокладками.