Окись меди применение
Окись меди применение
Оксид меди (I, II, III): свойства, получение, применение
Как вам известно, в химии существует четыре класса неорганических соединений. Веществ, представляющих каждый из них, очень много, но лидирующее положение, несомненно, занимают оксиды. У одного химического элемента может быть сразу несколько разных бинарных соединений с кислородом. Такое свойство имеет и медь. У нее существует три оксида. Давайте рассмотрим их детальнее.

Оксид меди (I)
Его формула — Cu2O. В некоторых источниках данное соединение могут называть гемиоксидом меди, оксидом димеди или закисью меди.
Свойства
Является кристаллическим веществом, имеющим коричнево-красный цвет. Этот оксид не растворяется в воде и этиловом спирте. Может плавиться, не разлагаясь, при температуре чуть больше 1240 о С. Данное вещество не взаимодействует с водой, но может переводиться в раствор, если участниками реакции с ним будут концентрированные хлоровородная кислота, щелочь, азотная кислота, гидрат аммиака, соли аммония, серная кислота.
Получение оксида меди (I)
Его можно получить, нагрев металлическую медь, или в такой среде, где кислород имеет малую концентрацию, а также в токе некоторых оксидов азота и вместе с оксидом меди (II). Кроме того, он может стать продуктом реакции термического разложения последнего. Оксид меди (I) получится и в том случае, если нагреть сульфид меди (I) в токе кислорода. Есть и другие, более сложные способы его получения (например, восстановление одного из гидроксидов меди, ионный обмен любой соли одновалентной меди с щелочью и т.п.), но их практикуют только в лабораториях.
Применение
Нужен в качестве пигмента, когда окрашивают керамику, стекло; компонента красок, которые защищают подводную часть судна от обрастания. Используется также как фунгицид. Без него не обходятся и меднозакисные вентили.

Оксид меди (II)
Его формула — CuO. Во многих источниках может встречаться под названием окиси меди.
Свойства
Это высший оксид меди. Вещество имеет вид черных кристаллов, которые почти не растворяются в воде. Взаимодействует с кислотой и при этой реакции образует соответствующую соль двухвалентной меди, а также воду. При его сплавлении с щелочью продукты реакции представлены купратами. Разложение оксида меди (II) происходит при температуре около 1100 о С. Аммиак, монооксид углерода, водород и уголь способны извлекать из этого соединения металлическую медь.
Получение
Его можно получить при нагревании металлической меди в воздушной среде при одном условии — температура нагревания должна быть ниже 1100 о С. Также оксид меди (II) может получиться, если нагреть карбонат, нитрат, двухвалентный гидроксид меди.
Применение
С помощью данного оксида окрашивают в зеленый или синий цвет эмаль и стекло, а также производят медно-рубиновую разновидность последнего. В лаборатории этим оксидом обнаруживают восстановительные свойства веществ.

Оксид меди (III)
Его формула — Cu2O3. Имеет традиционное название, которое звучит, наверное, немного необычно — окисел медь.
Свойства
Имеет вид красных кристаллов, не растворяющихся в воде. Разложение этого вещества происходит при температуре 400 о С, продукты данной реакции — оксид меди (II) и кислород.
Получение
Его можно получить, окисляя двухвалентный гидроксид меди с помощью пероксидисульфата калия. Необходимое условие реакции — щелочная среда, в которой она должна происходить.
Применение
Данное вещество само по себе не используется. В науке и промышленности более широкое распространение находят продукты его разложения — оксид меди (II) и кислород.
Заключение
Вот и все оксиды меди. Их несколько из-за того, что медь имеет переменную валентность. Существуют и другие элементы, у которых есть по несколько оксидов, но о них поговорим в другой раз.
Формула оксида меди, свойства, риски и использование
оксид меди, также называется оксидом меди (II), представляет собой химическое соединение формулы CuO. Его структура показана на рисунке 1 (EMBL-EBI, 2017).
Оксид меди встречается в природе как один из компонентов минералов, таких как тенорит и паралаконит. Он добывается из полезных ископаемых по всему миру, в основном в Южной Америке, в таких странах, как Перу, Боливия.

Некоторые химические соединения, такие как карбонат аммония и аммиак, используются для стимулирования добычи полезных ископаемых..

Оксид меди получают в основном путем извлечения в минералах, однако существует определенный процесс его промышленного производства..
В промышленности оксид меди получают реакцией воспламенения тригидрата нитрата меди (100-20 ° C), гидроксида меди (100 ° C) или карбоната меди (250 ° C):
Его также получают синтетическим путем, нагревая металлическую медь на воздухе приблизительно при 800 ° С (формула оксида меди, S.F.).
Физико-химические свойства оксида меди
Оксид меди (II). Представляется в виде тонкого черного порошка с ионной структурой. Его внешний вид показан на рисунке 3.

Молекула образована двухвалентной катионной медью Cu + 2 и анионным кислородом O-2. Молекулы образуют моноклинную кристаллическую систему, где каждый атом меди координируется 4 атомами кислорода..
Он тесно связан с другим оксидом меди: оксидом меди Cu2O (Национальный центр биотехнологической информации, 2005)..
Его молекулярная масса составляет 79,545 г / моль, а плотность — 6,315 г / мл. Его температура плавления составляет 1326 ° C, где он разлагается с выделением кислорода, его температура кипения выше 2000 ° C.
Соединение нерастворим в воде, спирте, гидроксиде аммония, карбонате аммония и растворим в хлориде аммония и цианиде калия (Royal Society of Chemistry, 2015).
Оксид меди является амфотерным, поэтому он может растворяться в кислотах и щелочных растворах. В щелочном растворе реагирует с образованием других солей меди:
В кислотных растворах он также реагирует с образованием других солей меди:
Он взрывается при нагревании в контакте с алюминием, водородом или магнием. Кроме того, при нагревании образуются токсичные пары..
Реактивность и опасности
Оксид меди (II) чрезвычайно ядовит и токсичен при проглатывании. Вызывает повреждение центральной нервной системы и эндокринной системы (AZoM, 2013).
Это также раздражает глаза и кожу. Негорючий, стабильный и несовместимый с восстановителями, сероводородом, алюминием, щелочными металлами, тонкоизмельченными металлами (Fisher scientiffic, 2009).
В случае попадания в глаза, следует проверить, носите ли вы контактные линзы, и немедленно снять их..
Глаза следует промыть проточной водой не менее 15 минут, держа веки открытыми. Вы можете использовать холодную воду. Мазь не следует использовать для глаз.
Если химическое вещество попало на одежду, удалите его как можно быстрее, защищая свои руки и тело. Поместите жертву под безопасный душ.
Если химическое вещество накапливается на незащищенной коже жертвы, например на руках, аккуратно и осторожно промойте кожу, загрязненную проточной водой и неабразивным мылом..
Вы можете использовать холодную воду. Если раздражение не проходит, обратитесь к врачу. Выстирать загрязненную одежду перед повторным использованием.
Если контакт с кожей серьезный, его следует промыть дезинфицирующим мылом и покрыть кожу, загрязненную антибактериальным кремом..
В случае вдыхания пострадавшему должно быть разрешено отдыхать в хорошо проветриваемом помещении. Если вдыхание серьезное, пострадавшего следует как можно скорее эвакуировать в безопасное место..
Ослабьте тесную одежду, такую как воротник рубашки, ремни или галстук. Если пострадавшему трудно дышать, следует назначить кислород.
Если пострадавший не дышит, проводится реанимация из уст в уста. Всегда принимая во внимание, что человеку, оказывающему помощь в проведении реанимации изо рта в рот, может быть опасно, когда вдыхаемый материал токсичен, инфекционен или вызывает коррозию.
В случае проглатывания не вызывать рвоту. Ослабьте тесную одежду, такую как воротники рубашки, ремни или галстуки. Если пострадавший не дышит, проведите реанимацию из уст в уста.
Во всех случаях вам следует немедленно обратиться к врачу (паспорт безопасности материала Оксид меди, 2013 г.).
приложений
Оксид меди используется в качестве пигмента для кристаллов, фарфоровых эмалей и искусственных драгоценных камней. Оксид добавляет к таким материалам голубовато-зеленоватый оттенок.
Он также используется в качестве десульфурирующего агента для нефтяных газов и в качестве катализатора окисления и в гальванических электродах (Encyclopædia Britannica, 2017).
Оксид меди широко используется в химической и сельскохозяйственной химической промышленности для производства промежуточных продуктов в некоторых процессах..
Это широко используемый окислитель / восстановитель и регулятор процесса в химической реакции, особенно в производстве нефти..
Оксид меди используется для производства красок и покрытий, а также является компонентом некоторых продуктов по уходу за воздухом..
Редко используемый в качестве пищевой добавки у животных, он также имеет применение в качестве полупроводника p-типа из-за его узкой запрещенной зоны. Он используется в качестве альтернативы оксида железа в термитах.
Из-за своих фунгицидных и микробицидных свойств оксид меди (II) также находит применение в качестве инсектицида и фумиганта..
Он используется в основном при обработке растений картофеля и в качестве противообрастающего средства в корпусах судов. Средство против обрастания — это материал, предотвращающий образование ракушек и других организмов на дне лодки..
Когда эти организмы растут в корпусе корабля, они увеличивают трение, возникающее при прохождении корабля через воду, тем самым снижая его скорость..
Смесь также используется в качестве консерванта для древесины, для защиты столбов забора, стружки, настила, кровли, черепицы, морских стен и других пресноводных и морских сооружений от насекомых и грибков. (Томсон Гейл, 2006).
Оксид меди (II), свойства, получение, химические реакции
Оксид меди (II), свойства, получение, химические реакции.










Оксид меди (II) – неорганическое вещество, имеет химическую формулу CuO.
Химические свойства оксида меди (II)
Краткая характеристика оксида меди (II):
Оксид меди (II) – неорганическое вещество черного цвета.
Так как валентность меди меняется и равна одному, двум или трем, то оксид меди содержит соответственно два атома меди и один атом кислорода, один атом меди и один атом кислорода, два атома меди и три атома кислорода.
Оксид двухвалентной меди содержит соответственно один атом меди и один атом кислорода.
Химическая формула оксида меди (II) CuO.
Порошок. Не растворяется в воде.
Физические свойства оксида меди (II):
| Наименование параметра: | Значение: |
| Химическая формула | CuO |
| Синонимы и названия иностранном языке | меди окись (устар. рус.) |
сopper (II) oxide (англ.)
Получение оксида меди (II):
Оксид меди (II) получается в результате следующих химических реакций:
1. окисления меди:
2. термического разложения гидроксида меди (II), нитрата меди (II), карбоната меди (II):
3. нагревания малахита:
Химические свойства оксида меди (II). Химические реакции оксида меди (II):
Оксид меди (II) относится к основным оксидам.
Химические свойства оксида меди (II) аналогичны свойствам основных оксидов других металлов . Поэтому для него характерны следующие химические реакции:
1. реакция оксида меди (II) с водородом:
CuО + H2 → Cu + H2О (t = 300 o C).
В результате реакции образуется медь и вода .
2. реакция оксида меди (II) с углеродом:
CuО + С → Cu + СО (t = 1200 o C).
В результате реакции образуется медь и оксид углерода .
3. реакция оксида меди (II) с серой:
CuО + 2S → Cu + S2О (t = 150-200 o C).
Реакция протекает в вакууме. В результате реакции образуется медь и оксид серы .
4. реакция оксида меди (II) с алюминием:
3CuО + 2Al → 3Cu + Al2О3 (t = 1000-1100 o C).
В результате реакции образуется медь и оксид алюминия .
5. реакция оксида меди (II) с медью:
CuО + Cu → Cu2О (t = 1000-1200 o C).
В результате реакции образуется оксид меди (I).
6. реакция оксида меди (II) с оксидом лития :
Реакция протекает в токе кислорода. В результате реакции образуется купрат лития.
7. реакция оксида меди (II) с оксидом натрия :
Реакция протекает в токе кислорода. В результате реакции образуется купрат натрия.
8. реакция оксида меди (II) с оксидом углерода :
CuО + СО → Cu + СО2.
В результате реакции образуется медь и оксид углерода (углекислый газ).
9. реакция оксида меди (II) с оксидом железа :
В результате реакции образуется соль – феррит меди. Реакция протекает при прокаливании реакционной смеси.
10. реакция оксида меди (II) с плавиковой кислотой:
В результате химической реакции получается соль – фторид меди и вода.
11. реакция оксида меди (II) с азотной кислотой:
В результате химической реакции получается соль – нитрат меди и вода .
Аналогично проходят реакции оксида меди (II) и с другими кислотами.
12. реакция оксида меди (II) с бромистым водородом (бромоводородом):
В результате химической реакции получается соль – бромид меди и вода .
13. реакция оксида меди (II) с йодоводородом:
В результате химической реакции получается соль – йодид меди и вода .
14. реакция оксида меди (II) с гидроксидом натрия :
В результате химической реакции получается соль – купрат натрия и вода .
15. реакция оксида меди (II) с гидроксидом калия :
В результате химической реакции получается соль – купрат калия и вода .
16. реакция оксида меди (II) с гидроксидом натрия и водой:
Гидрокосид натрия растворен в воде. Раствор гидроксида натрия в воде 20-30 %. Реакция протекает при киппении. В результате химической реакции получается тетрагидроксокупрат натрия.
17. реакция оксида меди (II) с надпероксидом калия:
В результате химической реакции получается соль – купрат (III) калия и кислород .
18. реакция оксида меди (II) с пероксидом калия:
В результате химической реакции получается соль – купрат (III) калия.
19. реакция оксида меди (II) с пероксидом натрия:
В результате химической реакции получается соль – купрат (III) натрия.
20. реакция оксида меди (II) с аммиаком:
3CuO + 2NH3 → N2 + 3Cu + 3H2O (t = 500-550 o C).
Аммиак пропускают через нагретый оксид меди (II). В результате химической реакции получается азот, медь и вода.
В результате химической реакции получается нитрид меди, азот и вода.
21. реакция оксида меди (II) и йодида алюминия:
В результате химической реакции получаются соль – йодид меди, оксид алюминия и йод.
Применение и использование оксида меди (II):
Оксид меди используется для производства стекла и эмалей для придания им соответствующей окраски (зеленой, синей, медно-рубиновой).
Примечание: © Фото //www.pexels.com, //pixabay.com










оксид меди реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида меди
реакции с оксидом меди
- ← Карбин
- Оксид железа (III), свойства, получение, химические реакции →
Справочники
Мировая экономика
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 347)
- Экономика Второй индустриализации России (102 293)
- Программа искусственного интеллекта ЭЛИС (26 777)
- Метан, получение, свойства, химические реакции (22 734)
- Этилен (этен), получение, свойства, химические реакции (21 405)
- Природный газ, свойства, химический состав, добыча и применение (20 227)
- Крахмал, свойства, получение и применение (19 835)
- Целлюлоза, свойства, получение и применение (18 502)
- Прямоугольный треугольник, свойства, признаки и формулы (18 071)
- Пропилен (пропен), получение, свойства, химические реакции (17 991)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Окись меди
Окись меди
| Оксид меди(II) | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Оксид меди(II)) |
| Химическая формула | CuO |
| Отн. молек. масса | 79.545 а. е. м. |
| Молярная масса | 79.545 г/моль |
| Физические свойства | |
| Плотность вещества | 6.31 г/мл г/см³ |
| Состояние (ст. усл.) | черный порошок |
| Термические свойства | |
| Температура плавления | 1447 [1] °C |
| Температура разложения | 1100 °C |
| Химические свойства | |
| Растворимость в воде | нерастоворим г/100 мл |
| Классификация | |
| номер CAS | [1317-38-0] |

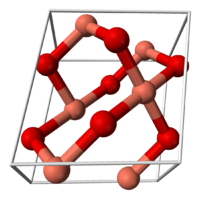
Окси́д ме́ди(II) (окись меди) CuO — основный оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
Кристаллическая решётка оксида меди относится к типу моноклинных решёток, с симметрией группы C2h и параметрами решётки a = 4.6837(5), b = 3.4226(5), c = 5.1288(6), α = 90° , β = 99.54(1)°, γ = 90°. Атом меди окружён четырьмя атомами кислорода и имеет искажённую плоскую конфигурацию.
Содержание
Получение
Получить оксид меди(II) можно:
- нагревая металлическую медь на воздухе (при температурах выше 1100 °C получается оксид меди(II)):
- нагревая гидроксид меди(II), её нитрат или карбонат:
Химические свойства
Оксид меди(II) реагирует с кислотами с образованием соответствующих солей меди(II) и воды:
При сплавлении CuO со щелочами образуются купраты:
При нагревании до 1100 °C разлагается:
Оксиду меди(II) соответствует гидроксид меди(II) Cu(OH)2, который является очень слабым основанием. Он способен растворяться в концентрированных растворах щелочей с образованием комплексов (то есть обладает слабыми амфотерными свойствами):
Оксид меди(II) может быть восстановлен до металлической меди при помощи аммиака, монооксидом углерода или водородом:
Применение
CuO используют при производстве стекла и эмалей для придания им зелёной и синей окраски. Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
В лабораториях применяют для обнаружения восстановительных свойств веществ. Вещество восстанавливает оксид до металлической меди, при этом цвет становится розовым.
Литература
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- The effect of hydrostatic pressure on the ambient temperature structure of CuO, Forsyth J.B., Hull S., J. Phys.: Condens. Matter 3 (1991) 5257-5261
Примечания
- ↑ под давлением О2
Wikimedia Foundation . 2010 .
- Окись магния
- Окись кобальта
Смотреть что такое «Окись меди» в других словарях:
Меди окислы — соединения меди с кислородом: оксид М. (I) закись Cu2O, оксид М. (II) окись CuO, оксид М. (Ill) Cu2O3 и перекись CuO2. Окисел Cu2O3 нестоек, см. Медь. Окись меди CuO встречается в природе в виде минерала Тенорита (мелаконита) чёрного… … Большая советская энциклопедия
меди окись — vario(II) oksidas statusas T sritis chemija formulė CuO atitikmenys: angl. copper(II) oxide; cupric oxide rus. меди окись; меди(II) оксид ryšiai: sinonimas – vario monoksidas … Chemijos terminų aiškinamasis žodynas
меди(II) оксид — vario(II) oksidas statusas T sritis chemija formulė CuO atitikmenys: angl. copper(II) oxide; cupric oxide rus. меди окись; меди(II) оксид ryšiai: sinonimas – vario monoksidas … Chemijos terminų aiškinamasis žodynas
Меди галогениды — соединения меди с галогенами: CuX и CuX2 (где Х F, Cl, Br и I). Способность раствора CuCI в концентрированной соляной кислоте абсорбировать на холоду окись углерода CO с образованием CuCICO используется в газовом анализе. Из галогенидов 2 … Большая советская энциклопедия
Окись — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
Окись фтора — Фторид кислорода(II) Общие Систематическое наименование Фторид кислорода (II) Химическая фо … Википедия
Спектральный метод определения никеля, алюминия, магния, марганца, кобальта, олова, меди и циркония в ниобии — 4.2. Спектральный метод определения никеля, алюминия, магния, марганца, кобальта, олова, меди и циркония в ниобии Спектральному методу предшествует перевод анализируемой пробы в пятиокись ниобия. Метод основан на измерении интенсивности линий… … Словарь-справочник терминов нормативно-технической документации
Оксид меди(II) — Оксид меди(II) … Википедия
Оксид меди (II) — Оксид меди(II) Общие Систематическое наименование Оксид меди(II)) Химическая формула … Википедия
Хлорид меди(I) — У этого термина существуют и другие значения, см. Хлорид меди. Хлорид меди(I) … Википедия
Окись меди применение
CuO(к, ж). Термодинамические свойства кристаллического и жидкого оксида меди в стандартном состоянии при температурах 100 – 3000 К приведены в табл. CuO_c.
Значения постоянных, принятые для расчета термодинамических функций CuO(к, ж), приведены в табл. Cu.1. За стандартное состояние CuO(к) в интервале 0 – 1500 К принята моноклинная модификация CuO (минерал тенорит).
При Т £ 298.15K теплоемкость CuO(к) измерена Милларом [29MIL] (71 — 271.4 K, образец содержал 0.6% примеси Cu2O), Ху и Джонстоном [53HU/JOH] (15 — 300 K, образец чистотой 99.95%), Лорамом и др. [89LOR/MIR] (1.5 — 340 K, чистота образца 99.99%, погрешность измерений
0.5%), Юнодом и др. [89JUN/ECK] (1 — 330 K, промышленный поликристаллический образец
99% чистоты ) и Гмелиным и др. [90GME/BRI] (1.8 — 1000 K, монокристалл CuO). Большое число измерений теплоемкости CuO при низких температурах, появившихся в последнее время, связано с изучением свойств материалов, проявляющих высокотемпературную сверхпроводимость. Наиболее достоверными из них представляются данные Гмелина и др. [90GME/BRI], результаты которых приняты в справочнике. Данные остальных работ согласуются с принятыми в пределах погрешности для вычисленных значений S ° (298.15·K) и H ° (298.15·K) — H ° (0) (см. табл. Cu.1), которые составляют 0.2 Дж × K ‑1 × моль ‑1 и 0.03 кДж × моль ‑1 соответственно.
При Т > 298.15 K уравнение для теплоемкости CuO(к) выведено по измерениям энтальпии в работе Ма и др. [67MAH/PAN] (410 — 1400 K, исследованный образец согласно данным химического анализа содержал 99.94% CuO, 0.03% Al2О3 и 0.03% SiО2). Погрешность измерений по оценке авторов [67MAH/PAN] не превышала 0.3%. Данные по теплоемкости CuO [87DEM/TEP] (300 — 900 K) и [90GME/BRI] (300 – 1000 К) согласуются с принятым уравнением для теплоемкости CuO в пределах
1%. Информация об экспериментальном определении температуры и энтальпии плавления CuO в литературе отсутствует. Оценки точки плавления CuO приводят к значениям от 1400 К до 1700 К. В справочнике принимается температура конгруэнтного плавления CuO 1500 К при давлении кислорода 24.4 атм., рассчитанная Шмидтом [83SCH]. Энтальпия плавления 49 кДж·моль ‑1 оценена в предположении равенства энтропий плавления CuO и FeO. Теплоемкость расплава CuO оценена по приближенному соотношению Cp ° (CuO, ж) = 33.5·n = 67 Дж·K ‑1 ·моль ‑1 .
Погрешности вычисленных значений F ° (Т) при 298.15, 1000, 2000 и 3000 К оцениваются в 0.2, 0.5, 3 и 8 Дж × K ‑1 × моль ‑1 ·соответственно. Термодинамические функции CuO(к), приведенные в справочниках JANAF [85CHA/DAV] и Барина [95BAR] и в табл. CuO_c, различаются при Т ° (T) в пределах 0.2 Дж × K ‑1 × моль ‑1 . Расчеты термодинамических функций CuO(ж) в справочной литературе ранее не проводились.
Константа равновесия реакции CuO(к) = Cu(г) + O(г) вычислена с использованием значения D rH ° (0) = 737.168 ± 2.2 кДж × моль ‑1 , соответствующего принятой энтальпии образования:
D fH ° (CuO, к, 298.15К) = -155.8 ± 1.0 кДж × моль ‑1 .
Значение основано на результатах, представленных в табл. Cu.6. Величина принята на основании большого количества хорошо согласующихся исследований равновесия 4CuO(к) = 2Cu2O(к) + O2(г) (раздел 1 таблицы). Не учитывались имеющие низкую точность результаты [22MOL/PAY, 23RUE/NAK] и результаты косвенных масс-спектрометрических измерений [69КАЗ/ЧИЖ, 73ЩЕД/ТЕЛ]. Среднее по остальным 20 работам составляет -155.8 ± 0.3 кДж × моль ‑1 . Погрешность принятого значения включает также ± 0.9 кДж × моль ‑1 — вклад за счет неточности термодинамических функций CuO(к), и ± 0.3 кДж × моль ‑1 — вклад за счет неточности энтальпии образования Cu2O(к) (без учета неточности термодинамических функций, см. соответствующий текст). Из результатов исследований других равновесий наибольшего доверия заслуживают работы [68CHA/FLE, 70BAR], приводящие к близким результатам. Калориметрические измерения представляются менее надежными. В работе Ма и др. [67MAH/PAN] выполнены достаточно точные измерения энтальпии сгорания меди в кислороде; эти измерения согласуются с принятыми в данном издании величинами удовлетворительно; подробно эта работа рассмотрена в тексте по Сu2O(к).
Бергман Г.А. bergman@yandex.ru
Гусаров А.В. a-gusarov@yandex.ru
Оксид меди CuO(к,ж)
M = 79.5454
D H ° (0) = -153.566 кДж × моль -1
D H ° (298.15 K) = -155.800 кДж × моль -1
S ° яд = 16.816 Дж × K -1 × моль -1
Таблица Cu.1. Принятые значения термодинамических величин для меди и ее соединений в кристаллической и жидкой фазах.
Материалы, используемые в кабельной промышленности
Медь (лат. Cuprum) — химический элемент I группы периодической системы Менделеева (атомный номер 29, атомная масса 63,546). В соединения медь обычно проявляет степени окисления +1 и +2, известны также немногочисленные соединения трехвалентной меди. Важнейшие соединения меди: оксиды Cu2O, CuO, Cu2O3; гидроксид Cu(OH)2, нитрат Cu(NO3)2.3H2O, сульфид CuS, сульфат(медный купорос) CuSO4.5H2O, карбонат CuCO3.Cu(OH)2, хлорид CuCl2.2H2O.
Медь — один из семи металлов, известных с глубокой древности. Переходный период от каменного к бронзовому веку (4 — 3-е тысячелетие до н.э.) назывался медным веком или халколитом ( от греческого chalkos — медь и lithos — камень) или энеолитом (от латинского aeneus — медный и греческого lithos — камень). В этот период появляются медные орудия. Известно, что при возведении пирамиды Хеопса использовались медные инструменты.
Чистая медь — ковкий и мягкий металл красноватого, в изломе розового цвета, местами с бурой и пестрой побежалостью, тяжелый (плотность 8,93 г/см 3 ) , отличный проводник тепла и электричества, уступая в этом отношении только серебру (температура плавления 1083 o C). Медь легко вытягивается в проволоку и прокатывается в тонкие листы, но сравнительно мало активна. В сухом вохдухе и кислороде при нормальных условиях медь не окисляется. Но она достаточно легко вступает в реакции: уже при комнатной температуре с галогенами, например с влажным хлором образует хлорид CuCl2, при нагревании с серой образует сульфид Cu2S, с селеном. Но с водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах. Кислоты, не обладающие окислительными свойствами, на медь не действуют, например, соляная и разбавленная серная кислоты. Но в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соотвествующих солей:
В атмосфере, содержащей CO2, пары H2O и др., покрывается патиной — зеленоватой пленкой основного карбоната (Cu2(OH)2CO3)), ядовитого вещества.
Медь входит более чем в 170 минералов, из которых для промышленности важны лишь 17, в том числе: борнит (пестрая медная руда — Cu5FeS4), халькопирит (медный колчедан — CuFeS2), халькозин (медный блеск — Cu2S), ковеллин (CuS), малахит (Cu2(OH)2CO3). Встречается также самородная медь
- Плотность меди — 8,93*103кг/м 3 ;
- Удельный вес меди — 8,93 г/cм 3 ;
- Удельная теплоемкость меди при 20 o C — 0,094 кал/град;
- Температура плавления меди — 1083 o C ;
- Удельная теплота плавления меди — 42 кал/г;
- Температура кипения меди — 2600 o C ;
- Коэффициент линейного расширения меди
- (при температуре около 20 o C) — 16,7 *106(1/град);
- Коэффициент теплопроводности меди — 335ккал/м*час*град;
- Удельное сопротивление меди при 20 o C — 0,0167 Ом*мм 2 /м;
Модули упругости алюминия и коэффициент Пуассона
Соединения меди
Оксид меди (I) Cu2O3 и закись меди (I) Cu2O, как и другие соединения меди (I) менее устойчивы, чем соединения меди (II). Оксид меди (I), или закись меди Cu2O в природе встречается в виде минерала куприта. Кроме того, она может быть получена в виде осадка красного оксида меди (I) в результате нагревания раствора соли меди (II) и щелочи в присутствии сильного восстановителя. Оксид меди (II), или окись меди, CuO — черное вещество, встречающееся в природе (например в виде минерала тенерита). Его получают прокаливанием гидроксокарбоната меди (II) (CuOH)2CO3 или нитрата меди (II) Cu(NO2)2. Оксид меди (II) хороший осислитель. Гидроксид меди (II) Cu(OH)2 осаждается из растворов солей меди (II) при действии щелочей в виде голубой студенистой массы. Уже при слабом нагревании даже под водой он разлагается, превращаясь в черный оксид меди (II). Гидроксид меди (II) — очень слабое основание. Поэтому растворы солей меди (II) в большинстве случаев имеют кислую реакцию, а со слабыми кислотами медь образует основные соли. Сульфат меди (II) CuSO4 в безводном состоянии представляет собой белый порошок, который при поглощении воды синеет. Поэтому он применяется для обнаружения следов влаги в органических жидкостях. Водный раствор сульфата меди имеет характерный сине-голубой цвет. Эта окраска свойственна гидратированным ионам [Cu(H2O)4]2+, поэтому такую же окраску имеют все разбавленные растворы солей меди (II), если только они не содердат каких-либо окрашенных анионов. Из водных растворов сульфат меди кристаллизуется с пятью молекулами воды, образуя прозрачные синие кристаллы медного купороса. Медный купорос применяется для электролитического покрытия металлов медью, для приготовления минеральных красок, а также в качестве исходного вещества при получении других соединений меди. В сельском хозяйстве разбавленный раствор медного купороса применяется для опрыскивания растений и протравливания зерна перед посевом, чтобы уничтожить споры вредных грибков. Хлорид меди (II) CuCl2. 2H2O. Образует темно-зеленые кристаллы, легко растворимые в воде. Очень концентрированные растворы хлорида меди (II) имеют зеленый цвет, разбавленные — сине-голубой. Нитрат меди (II) Cu(NO3)2.3H2O. Получается при растворении меди в азотной кислоте. При нагревании синие кристаллы нитрата меди сначала теряют воду, а затем легко разлагаются с выделением кислорода и бурого диоксида азота, переходя в оксид меди (II). Гидроксокарбонат меди (II) (CuOH)2CO3. Встречается в природе в виде минерала малахита, имеющего красивый изумрудно-зеленый цвет. Искусственно приготовляется действием Na2CO3 на растворы солей меди (II). 2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3v + 2Na2SO4 + CO2^ Применяется для получения хлорида меди (II), для приготовления синих и зеленых минеральных красок, а также в пиротехнике. Ацетат меди (II) Cu (CH3COO)2.H2O. Получается обработкой металлической меди или оксида меди (II) уксусной кислотой. Обычно представляет собой смесь основных солей различного состава и цвета (зеленого и сине-зеленого). Под названием ярь-медянка применяется для приготовления масляной краски. Комплексные соединения меди образуются в результате соединения двухзарядных ионов меди с молекулами аммиака. Из солей меди получают разноообразные минеральные краски. Все соли меди ядовиты. Поэтому, чтобы избежать образования медных солей, медную посуду покрывают изнутри слоем олова (лудят).
Производство меди
Медь добывают из оксидных и сульфидных руд. Из сульфидных руд выплавляют 80% всей добываемой меди. Как правило, медные руды содержат много пустой породы. Поэтому для получения меди используется процесс обогащения. Медь получают методом ее выплавки из сульфидных руд. Процесс состоит из ряда операций: обжига, плавки, конвертирования, огневого и электролитического рафинирования. В процессе обжига большая часть примесных сульфидов превращается в оксиды. Так, главная примесь большинства медных руд пирит FeS2 превращается в Fe2O3. Газы, образующиеся при обжиге, содержат CO2, который используется для получения серной кислоты. Получающиеся в процессе обжига оксиды железа, цинка и других примесей отделяются в виде шлака при плавке. Жидкий медный штейн (Cu2S с примесью FeS) поступает в конвертор, где через него продувают воздух. В ходе конвертирования выделяется диоксид серы и получается черновая или сырая медь. Для извлечения ценных (Au, Ag, Te и т.д.) и для удаления вредных примесей черновая медь подвергается сначала огневому, а затем электролитическому рафинированию. В ходе огневого рафинирования жидкая медь насыщается кислородом. При этом примеси железа, цинка и кобальта окисляются, переходят в шлак и удаляются. А медь разливают в формы. Получающиеся отливки служат анодами при электролитическом рафинировании.
Основным компонентом раствора при электролитическом рафинировании служит сульфат меди — наиболее распространенная и дешевая соль меди. Для увеличения низкой электропроводности сульфата меди в электролит добавляют серную кислоту. А для получения компактного осадка меди в раствор вводят небольшое количество добавок. Металлические примеси, содержащиеся в неочищенной («черновой») меди, можно разделить на две группы.
- Fe, Zn, Ni, Co. Эти металлы имеют значительно более отрицательные электродные потенциалы, чем медь. Поэтому они анодно растворяются вместе с медью, но не осаждаются на катоде, а накапливаются в электролите в виде сульфатов. Поэтому электролит необходимо периодически заменять.
- Au, Ag, Pb, Sn. Благородные металлы (Au, Ag) не претерпевают анодного растворения, а в ходе процесса оседают у анода, образуя вместе с другими примесями анодный шлам, который периодически извлекается. Олово же и свинец растворяются вместе с медью, но в электролите образуют малорастворимые соединения, выпадающие в осадок и также удаляемые.
Сплавы меди
Сплавы, повышающие прочность и другие свойства меди, получают введением в нее добавок, таких, как цинк, олово, кремний, свинец, алюминий, марганец, никель. На сплавы идет более 30% меди.
Латуни — сплавы меди с цинком ( меди от 60 до 90% и цинка от 40 до 10%) — прочнее меди и менее подвержены окислению. При присадке к латуни кремния и свинца повышаются ее антифрикционные качества, при присадке олова, алюминия, марганца и никеля возрастает антикоррозийная стойкость. Листы, литые изделия используются в машиностроении, особенно в химическом, в оптике и приборостроении, в производстве сеток для целлюлознобумажной промышленности.
Бронзы. Раньше бронзами называли сплавы меди (80-94%) и олова (20-6%). В настоящее время производят безоловянные бронзы, именуемые по главному вслед за медью компоненту.
- Алюминиевые бронзы содержат 5-11% алюминия, обладают высокими механическими свойствами в сочетании с антикоррозийной стойкостью.
- Свинцовые бронзы, содержащие 25-33% свинца, используют главным образом для изготовления подшипников, работающих при высоких давлениях и больших скоростях скольжения.
- Кремниевые бронзы, содержащие 4-5% кремния, применяют как дешевые заменители оловянных бронз.
- Бериллиевые бронзы, содержащие 1,8-2,3% бериллия, отличаются твердостью после закалки и высокой упругостью. Их применяют для изготовления пружин и пружинящих изделий.
- Кадмиевые бронзы — сплавы меди с небольшим количества кадмия (до1%) — используют при производстве троллейных проводов, для изготовления арматуры водопроводных и газовых линий и в машиностроении.
Припои — сплавы цветных металлов, применяемые при пайке для получения монолитного паяного шва. Среди твердых припоев известен медносеребряный сплав (44,5-45,5% Ag; 29-31% Cu; остальное — цинк).
Применение меди
Медь, ее соединения и сплавы находят широкое применение в различных отраслях промышленности.
В электротехнике медь используется в чистом виде: в производстве кабельных изделий, шин голого и контактного проводов, электрогенераторов, телефонного и телеграфного оборудования и радиоаппаратуры. Из меди изготавливают теплообменники, вакуум-аппараты, трубопроводы. Более 30% меди идет на сплавы. Сплавы меди с другими металлами используют в машиностроении, в автомобильной и тракторной промышленности (радиаторы, подшипники), для изготовления химической аппаратуры.
Высокая вязкость и пластичность металла позволяют применять медь для изготовления разнообразных изделий с очень сложным узором. Проволока из красной меди в отожженном состоянии становится настолько мягкой и пластичной, что из нее без труда можно вить всевозможные шнуры и выгибать самые сложные элементы орнамента. Кроме того, проволока из меди легко спаивается сканым серебряным припоем, хорошо серебрится и золотится. Эти свойства меди делают ее незаменимым материалом при производстве филигранных изделий.
Коэффициент линейного и объемного расширения меди при нагревании приблизительно такой же , как у горячих эмалей, в связи с чем при остывании эмаль хорошо держится на медном изделии, не трескается , не отскакивает. Благодаря этому мастера для производства эмалевых изделий предпочитают медь всем другим металлам.
Как и некоторые другие металлы, медь входит в число жизненно важных микроэлементов. Она участвует в процессе фотосинтеза и усвоении растениями азота, способствует синтезу сахара, белков, крахмала, витаминов. Чаще всего медь вносят в почву в виде пятиводного сульфата — медного купороса CuSO4.5H2O. В большом количестве он ядовит, как и многие другие соединения меди, особенно для низших организмов. В малых же дозах медь необходима всему живому.
- Как организовать мероприятие любого масштаба — от деловой встречи до крупной конференции
- Полимерные люки в Москве: современное решение практических задач
- Как правильно транспортировать арендованную технику на объект
- Силиконовый дренаж для инженерных систем
- Как пройти аттестацию по охране труда без ошибок