Взаимодействует ли медь с водой?
Взаимодействует ли медь с водой?
Растворимость меди в воде и кислотах

В основе химических свойств большинства элементов лежит их способность к растворению в водной среде и кислотах. Изучение характеристики меди связано с малоактивным действием в обычных условиях. Особенностью её химических процессов является образование соединений с аммиаком, ртутью, азотной и серной кислотами. Низкая растворимость меди в воде не способна вызвать коррозионные процессы. Ей присущи особые химические свойства, позволяющие использовать соединение в разных отраслях промышленности.
Описание элемента
Медь считается старейшим из металлов, который научились добывать люди ещё до нашей эры. Это вещество получают из природных источников в виде руды. Медью называют элемент химической таблицы с латинским наименованием cuprum, порядковый номер которого равен 29. В периодической системе он расположен в четвёртом периоде и относится к первой группе.

Природное вещество является розово-красным тяжёлым металлом с мягкой и ковкой структурой. Температура его кипения и плавления – более 1000 °С. Считается хорошим проводником.
Химическое строение и свойства
Если изучить электронную формулу медного атома, то можно обнаружить, что у него имеется 4 уровня. На валентной 4s-орбитали находится всего один электрон. Во время химических реакций от атома может отщепляться от 1 до 3 отрицательно заряжённых частиц, тогда получаются соединения меди со степенью окисления +3, +2, +1. Наибольшей устойчивостью обладают её двухвалентные производные.
В химических реакциях она выступает в качестве малоактивного металла. В обычных условиях растворимость меди в воде отсутствует. В сухом воздухе не наблюдается коррозия, зато при нагревании поверхность металла покрывается чёрным налётом из оксида двухвалентного. Химическая устойчивость меди проявляется при действии безводных газов, углерода, ряда органических соединений, фенольных смол и спиртов. Для неё характерны реакции комплексообразования с выделением окрашенных соединений. Медь обладает небольшим сходством с металлами щелочной группы, связанным с формированием производных одновалентного ряда.
Что такое растворимость?
Это процесс образования однородных систем в виде растворов при взаимодействии одного соединения с другими веществами. Их составляющими являются отдельные молекулы, атомы, ионы и другие частицы. Степень растворимости определяется по концентрации вещества, которое растворили при получении насыщенного раствора.

Единицей измерения чаще всего являются проценты, объёмные или весовые доли. Растворимость меди в воде, как и других соединений твёрдого вида, подчиняется лишь изменениям температурных условий. Эту зависимость выражают с помощью кривых. Если показатель очень маленький, то вещество считается нерастворимым.
Растворимость меди в водной среде
Металл проявляет коррозионную стойкость под действием морской воды. Это доказывает его инертность в обычных условиях. Растворимость меди в воде (пресной) практически не наблюдается. Зато во влажной среде и под действием углекислого газа на металлической поверхности происходит образование плёнки зелёного цвета, которая является основным карбонатом:
Если рассматривать её одновалентные соединения в виде соли, то наблюдается их незначительное растворение. Такие вещества подвержены быстрому окислению. В результате получаются соединения меди двухвалентные. Эти соли обладают хорошей растворимостью в водной среде. Происходит их полная диссоциация на ионы.
Растворимость в кислотах
Обычные условия протекания реакций меди со слабыми или разбавленными кислотами не способствуют их взаимодействию. Не наблюдается химический процесс металла со щелочами. Растворимость меди в кислотах возможна, если они являются сильными окислителями. Только в этом случае протекает взаимодействие.
Растворимость меди в азотной кислоте
Такая реакция возможна ввиду того, что происходит процесс окисления металла сильным реагентом. Кислота азотная в разбавленном и концентрированном виде проявляет окислительные свойства с растворением меди.

В первом варианте во время реакции получается меди нитрат и азота двухвалентный оксид в соотношении 75 % к 25 %. Процесс с разбавленной кислотой азотной можно описать следующим уравнением:
Во втором случае получается меди нитрат и азота оксиды двухвалентные и четырёхвалентные, соотношение которых 1 к 1. В этом процессе участвует 1 моль металла и 3 моля кислоты азотной концентрированной. При растворении меди происходит сильный разогрев раствора, в результате чего наблюдается термическое разложение окислителя и выделение дополнительного объёма азотных оксидов:
Реакцию используют в малотоннажном производстве, связанном с переработкой лома или удалением покрытия с отходов. Однако такой способ растворения меди имеет ряд недостатков, связанных с выделением большого количества азотных оксидов. Для их улавливания или нейтрализации необходимо специальное оборудование. Процессы эти весьма затратные.
Растворение меди считается завершённым, когда происходит полное прекращение выработки летучих азотистых оксидов. Температура реакции колеблется от 60 до 70 °C. Следующим этапом является спуск раствора из химического реактора. На его дне остаются небольшие куски металла, который не прореагировал. К полученной жидкости добавляют воду и проводят фильтрацию.
Растворимость в кислоте серной
В обычном состоянии такая реакция не протекает. Фактором, определяющим растворение меди в серной кислоте, является её сильная концентрация. Разбавленная среда не может окислить металл. Растворение меди в серной кислоте концентрированной протекает с выделением сульфата.

Процесс выражается следующим уравнением:
Свойства сульфата меди
Соль двухосновную ещё называют сернокислой, обозначают её так: CuSO4. Она представляет собой вещество без характерного запаха, не проявляющее летучесть. В безводной форме соль не имеет цвета, она непрозрачная, обладающая высокой гигроскопичностью. У меди (сульфат) растворимость хорошая. Молекулы воды, присоединяясь к соли, могут образовывать кристаллогидратные соединения. Примером служит купорос медный, который является пентагидратом голубого цвета. Его формула: CuSO4·5H2O.
Кристаллогидратам присуща прозрачная структура синеватого оттенка, они проявляют горьковатый, металлический привкус. Молекулы их способны со временем терять связанную воду. В природе встречаются в виде минералов, к которым относят халькантит и бутит.

Подвержен воздействию меди сульфат. Растворимость является реакцией экзотермической. В процессе гидратации соли выделяется значительное количество тепла.
Растворимость меди в железе
В результате этого процесса образуются псевдосплавы из Fe и Cu. Для металлического железа и меди возможна ограниченная взаимная растворимость. Максимальные её значения наблюдаются при температурном показателе 1099,85 °C. Степень растворимости меди в твёрдой форме железа равняется 8,5 %. Это небольшие показатели. Растворение металлического железа в твёрдой форме меди составляет около 4,2 %.
Снижение температуры до комнатных значений делает взаимные процессы незначительными. При расплавлении металлической меди, она способна хорошо смачивать железо в твёрдой форме. При получении псевдосплавов Fe и Cu используют особые заготовки. Их создают путём прессования или печения железного порошка, находящегося в чистой или легированной форме. Такие заготовки пропитывают жидкой медью, образуя псевдосплавы.
Растворение в аммиаке
Процесс часто протекает при пропускании NH3 в газообразной форме над раскалённым металлом. Результатом является растворение меди в аммиаке, выделение Cu3N. Это соединение называют нитридом одновалентным.
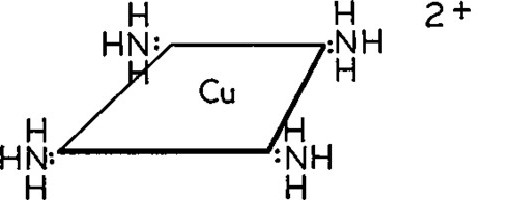
Соли её подвергаются воздействию раствора аммиачного. Прибавление такого реактива к медному хлориду приводит к выпадению осадка в виде гидроксида:
Аммиачный избыток способствует формированию соединения комплексного типа, имеющего окраску тёмно-синюю:
Этот процесс используют для определения ионов двухвалентной меди.
Растворимость в чугуне
В структуре ковкого перлитного чугуна помимо основных компонентов присутствует дополнительный элемент в виде обычной меди. Именно она повышает графитизацию углеродных атомов, способствует увеличению жидкотекучести, прочности и твёрдости сплавов. Металл положительно влияет на уровень перлита в конечном продукте. Растворимость меди в чугуне используют для проведения легирования исходного состава. Основной целью такого процесса является получение ковкого сплава. У него будут повышенные механические и коррозионные свойства, но уменьшено охрупчивание.
Если содержание меди в чугуне составляет около 1 %, то показатель прочности при проведении растяжения приравнивается к 40 %, а текучести увеличивается до 50 %. Это существенно изменяет характеристики сплава. Повышение количества металла, легирующего до 2 %, приводит к изменению прочности до значения 65 %, а показатель текучести становится равен 70 %. При большем содержании меди в составе чугуна труднее образуется шаровидный графит. Введение в структуру легирующего элемента не изменяет технологию формирования вязкого и мягкого сплава. Время, которое отводится для отжига, совпадает с продолжительностью такой реакции при производстве чугуна без примеси меди. Оно составляет около 10 часов.

Использование меди для изготовления чугуна с высокой концентрацией кремния не способно полностью устранить так называемое ожелезнение смеси во время отжига. В результате получают продукт с низкой упругостью.
Растворимость в ртути
При смешивании ртути с металлами других элементов получаются амальгамы. Этот процесс может проходить при комнатной температуре, ведь в таких условиях Pb представляет собой жидкость. Растворимость меди в ртути проходит только во время нагревания. Металл необходимо предварительно измельчить. При смачивании жидкой ртутью твёрдой меди происходит взаимное проникновение одного вещества в другое или процесс диффундирования. Значение растворимости выражается в процентах и составляет 7,4*10 -3 . В процессе реакции получается твёрдая простая амальгама, похожая на цемент. Если её немного нагреть, то она размягчается. В результате такую смесь используют для починки изделий из фарфора. Существуют ещё и сложные амальгамы с оптимальным содержанием в ней металлов. Например, в стоматологическом сплаве присутствуют элементы серебра, олова, меди и цинка. Их количество в процентах относится как 65: 27: 6:2. Амальгам с таким составом называется серебряным. Каждый компонент сплава выполняет определённую функцию, которая позволяет получить пломбу высокого качества.
Другим примером служит сплав амальгамный, в котором наблюдается высокое содержание меди. Его ещё называют медным сплавом. В составе амальгама присутствует от 10 до 30 % Cu. Высокое содержание меди препятствует взаимодействию олова со ртутью, что не позволяет образовываться очень слабой и коррозирующей фазе сплава. Кроме того, уменьшение количества в пломбе серебра приводит к удешевлению. Для приготовления амальгамы желательно использовать инертную атмосферу или защитную жидкость, которая образует плёнку. Металлы, входящие в состав сплава способны быстро окисляться воздухом. Процесс нагревания амальгамы купрума в присутствие водорода приводит к отгонке ртути, что позволяет отделить элементарную медь. Как видите, эта тема несложна для изучения. Теперь вы знаете, как медь взаимодействует не только с водой, но и с кислотами и другими элементами.
Медь в питьевой воде: опасность и способы устранения
Хотя вы, возможно, только недавно слышали об этой тенденции, она широко поддерживается Аюрведой, древней индийской системой целостной медицины.
Тем не менее вы можете задаться вопросом, полезна ли и безопасна ли эта практика или это еще одна причуда.
В этой статье рассматриваются предполагаемая польза и недостатки употребления медной воды.

Что такое медная вода?
Медная вода – это не напиток, который можно купить в ближайшем супермаркете или магазине товаров для здоровья. Скорее всего, вам придется хранить питьевую воду в медной емкости.
Медь – это микроэлемент, поэтому вам нужно лишь минимальное ее количество.
Она играет ключевую роль во многих важных функциях организма, таких как выработка энергии, образование соединительной ткани и в системе обмена химическими сообщениями вашего мозга. Она широко содержится в таких продуктах, как моллюски, орехи, семена, картофель, цельнозерновые продукты, черный шоколад и субпродукты ().
Сторонники этой практики заявляют, что хранение воды в медных емкостях позволяет металлу проникать в воду, что приносит пользу пьющему.
Тем не менее хотя и дефицит, и избыток могут быть вредными для вашего здоровья, дефицит меди встречается редко ().
Например, стандартный западный рацион питания покрывает или превышает рекомендуемую суточную норму потребления (РСНП) меди, которая установлена на уровне 0,9 мг ().
Под медной водой понимается вода, которая хранилась в медной емкости, что позволило ей наполниться минералом. Однако дефицит меди встречается редко, так как ваши ежедневные потребности в меди можно легко удовлетворить с помощью обычных продуктов.
Заявленные полезные свойства
Сторонники утверждают, что медная вода обладает множеством полезных свойств, включая улучшение здоровья сердца и мозга, более сильную иммунную систему и даже снижение массы тела, омолаживающие и дубильные эффекты.
Однако маловероятно, что медная вода оказывает такое воздействие на здоровье.
Вместо этого эти полезные свойства могут просто отражать роль и функции меди в вашем организме, учитывая, что она участвует в производстве энергии, пигментации, развитии тканей мозга и сердца, функции иммунной системы и ангиогенезе – формировании новых кровеносных сосудов ().
Антибактериальные свойства
Одно из полезных свойств меди подтверждено наукой – ее антибактериальный эффект.
Как старые, так и недавние данные свидетельствуют о том, что медь может использоваться в качестве системы очистки или стерилизации воды, как рекомендовали древние методы Аюрведы (, ).
Это может быть особенно полезно для примерно 1 миллиарда человек, которые не имеют доступа к безопасной питьевой воде ().
Загрязненная вода может содержать значительное количество бактерий, в том числе Vibrio cholerae, Shigella flexneri, Escherichia coli и Salmonella typhimurium, которые могут вызывать диарею – одну из основных причин смерти в развивающихся странах (, ).
К счастью, простое хранение воды в медном горшке или сосуде может убить эти вредные бактерии (, , , ).
Термин «контактное уничтожение» используется для описания антибактериального действия меди. Исследователи считают, что воздействие минерала вызывает обширное повреждение клеточных стенок бактерий, вызывая их гибель (, ).
Тем не менее исследователи сходятся во мнении, что для того, чтобы гарантировать успешный антибактериальный эффект, воду перед ее употреблением следует хранить в медной емкости в течение нескольких часов.
В некоторых исследованиях сообщалось об антибактериальном эффекте при хранении воды в течение ночи. Напротив, в других исследованиях предлагается ждать от 16 до 24 часов или даже до 48 часов (, , , ).
Это означает, что наполнение дорогих медных бутылок водой утром, чтобы избежать обезвоживания в течение дня, может не оказывать должного стерилизующего эффекта.
Скорее, может быть более полезным хранить воду в медных сосудах или банках дольше.
Хранение воды в медных емкостях, по-видимому, оказывает антибактериальный эффект, что способно убивать вредные бактерии. Однако, чтобы вода была полностью продезинфицирована, ее нужно хранить несколько часов, а возможно, и дней.
Физические и химические свойства меди
Свойства меди, которая в природе встречается и в виде достаточно крупных самородков, люди изучили еще в древние времена, когда из этого металла и его сплавов делали посуду, оружие, украшения, различные изделия бытового назначения. Активное использование данного металла на протяжении многих лет обусловлено не только его особыми свойствами, но и простотой обработки. Медь, которая присутствует в руде в виде карбонатов и окислов, достаточно легко восстанавливается, что и научились делать наши древние предки.
Интересное о меди
Изначально процесс восстановления этого металла выглядел очень примитивно: медную руду просто нагревали на кострах, а затем подвергали резкому охлаждению, что приводило к растрескиванию кусков руды, из которых уже можно было извлекать медь. Дальнейшее развитие такой технологии привело к тому, что в костры начали вдувать воздух: это повышало температуру нагревания руды. Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
О том, что медь используется человечеством с древних времен, свидетельствуют археологические находки, в результате которых были найдены изделия из данного металла. Историками установлено, что первые изделия из меди появились уже в 10 тысячелетии до н.
э, а наиболее активно она стала добываться, перерабатываться и использоваться спустя 8–10 тысяч лет.
Естественно, предпосылками к такому активному использованию данного металла стали не только относительная простота его получения из руды, но и его уникальные свойства: удельный вес, плотность, магнитные свойства, электрическая, а также удельная проводимость и др.
В наше время уже сложно найти медь в природе в виде самородков, обычно ее добывают из руды, которая подразделяется на следующие виды.
- Борнит — в такой руде медь может содержаться в количестве до 65%.
- Халькозин, который также называют медным блеском. В такой руде меди может содержаться до 80%.
- Медный колчедан, также называемый халькопиритом (содержание до 30%).
- Ковеллин (содержание до 64%).
Медь также можно извлекать из множества других минералов (малахит, куприт и др.). В них она содержится в разных количествах.
Физические свойства
Медь в чистом виде представляет собой металл, цвет которого может варьироваться от розового до красного оттенка.
Радиус ионов меди, имеющих положительный заряд, может принимать следующие значения:
- если координационный показатель соответствует 6-ти — до 0,091 нм;
- если данный показатель соответствует 2 — до 0,06 нм.
Радиус атома меди составляет 0,128 нм, также он характеризуется сродством к электрону, равном 1,8 эВ. При ионизации атома данная величина может принимать значение от 7,726 до 82,7 эВ.
Медь — это переходный металл, показатель электроотрицательности которого составляет 1,9 единиц по шкале Полинга. Кроме этого, его степень окисления может принимать различные значения. При температурах, находящихся в интервале 20–100 градусов, его теплопроводность составляет 394 Вт/м*К. Электропроводность меди, которую превосходит лишь серебро, находится в интервале 55,5–58 МСм/м.
Так как медь в потенциальном ряду стоит правее водорода, она не может вытеснять этот элемент из воды и различных кислот. Ее кристаллическая решетка имеет кубический гранецентрированный тип, величина ее составляет 0,36150 нм. Плавится медь при температуре 1083 градусов, а температура ее кипения — 26570. Физические свойства меди определяет и ее плотность, которая составляет 8,92 г/см3.
Из ее механических свойств и физических показателей стоит также отметить следующие:
- термическое линейное расширение — 0,00000017 единиц;
- предел прочности, которому медные изделия соответствуют при растяжении, составляет 22 кгс/мм2;
- твердость меди по шкале Бринелля соответствует значению 35 кгс/мм2;
- удельный вес 8,94 г/см3;
- модуль упругости составляет 132000 Мн/м2;
- значение относительного удлинения равно 60%.
Совершенно уникальными можно считать магнитные свойства данного металла, который является полностью диамагнитным. Именно эти свойства, наряду с физическими параметрами: удельным весом, удельной проводимостью и другими, в полной мере объясняют широкую востребованность данного металла при производстве изделий электротехнического назначения. Похожими свойствами обладает алюминий, который также успешно используется при производстве различной электротехнической продукции: проводов, кабелей и др.
Основную часть характеристик, которыми обладает медь, практически невозможно изменить, за исключением предела прочности. Данное свойство можно улучшить практически в два раза (до 420–450 МН/м2), если осуществить такую технологическую операцию, как наклеп.
Возможные недостатки
Длительное воздействие высоких доз меди может вызвать отравление медью, которое характеризуется тошнотой, рвотой, болями в животе и диареей. Это может даже привести к повреждению печени и заболеванию почек (, ).
Один из способов развития отравления медью – употребление застойной воды, протекающей по медьсодержащим трубам, которые позволяют выщелачивать большое количество меди в воду ().
Всемирная организация здравоохранения (ВОЗ) рекомендует потреблять не более 0,47 мг меди на чашку (2 мг на литр) воды. Это гарантирует, что допустимый верхний уровень потребления 10 мг в день не будет превышен ().
Что касается воды, хранящейся в медных контейнерах даже в течение периодов до 16 часов, исследования показывают, что количество выщелоченной меди значительно ниже пределов безопасности ВОЗ (, ).
Тем не менее сторонники этой тенденции предлагают ограничить потребление медной воды 3 чашками (710 мл) в день.
Высокое потребление меди может в долгосрочной перспективе привести к отравлению медью. Однако количество меди, которая выщелачивается в воду, хранящуюся в медных емкостях, ниже безопасных пределов.
Подведем итог
- Медная вода – это просто вода, которая хранилась в медной емкости. Это позволяет выщелачивать безопасное количество меди в воду.
- Хотя большая часть предполагаемой пользы этой практики не подтверждена научными исследованиями, она оказывает антибактериальный эффект, который может убивать вызывающие диарею бактерии в загрязненной воде.
- Однако исследования показывают, что для того, чтобы выщелоченная медь убила бактерии, воду необходимо хранить в медном сосуде, по крайней мере, в течение ночи или до 48 часов.
- Это означает, что лучшими контейнерами, скорее всего, будут медные горшки или банки, а не медные бутылки для воды, которые наполняются на непродолжительный период времени.
Метки: Вода, Медь
Об авторе: Александр Фёдоров
Кандидат биологических наук, биолог, эксперт по питанию. Закончил Ставропольский государственный университет по специальности «Биология» на биолого-химическом факультете.
-
Похожие записи
- Можно ли пить зеленый чай перед сном?
- Полезно ли пить теплое молоко с мёдом на ночь?
- Молоко из кешью: полезные свойства, рецепт приготовления
Свойства оксидов
Подобно другим химическим элементам, медь имеет бинарные соединения с кислородом, в частности, три вида оксидов:
- Cu2O – это кристаллическое вещество красно-коричневого цвета. Этот оксид меди в воде не растворяется, однако подвержен плавлению при температуре 1240°C. Используется как пигмент при окрашивании керамики. Также применяется в качестве фунгицида.
- CuO представляет собой черные кристаллы, которые практически не растворяются в воде. При взаимодействии с кислотами образует двухвалентную соль меди и воду. Используется при производстве медно-рубинового стекла, а также при окрашивании эмали в синие или зеленые цвета.
- Cu2O3 – это красные кристаллы, нерастворимые в воде. Разлагается вещество под влиянием температур около 400°C, в результате чего образуются CuO и О. Именно эти продукты, купрум (II) оксид и оксиген, находят широкое применение в науке и разных сферах промышленности.
Хром, железо и медь
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.

Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные, +6 — кислотные.

В природе хром встречается в виде следующих соединений.
- Fe(CrO2)2 — хромистый железняк, хромит
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит

В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
-
Реакции с неметаллами
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) — Cr2O3 — происходит пассивирование. Реагирует с неметаллами при нагревании.

Протекает в раскаленном состоянии.
Реакции с кислотами

С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Реакции с солями менее активных металлов
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Соединения хрома (II)
Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы — оксида хрома (III), реагирует с кислотами, кислотными оксидами.

Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.

Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).

Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании — смешанные оксиды. С кислотами оксид хрома (III) образует различные соли.
H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr +3 )

Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
Соединения хрома (VI)
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) — CrO3, и две кислоты, находящиеся в растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы — в оранжевый цвет.

Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» 🙂

В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.

Для железа характерны две основные степени окисления +2, +3, +6.

В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит

Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.

-
Реакции с неметаллами
Fe + S = FeS (t > 700°C)
Fe + S = FeS2 (t 2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] — гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий).
Качественной реакцией на ионы Fe 2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета.
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Гидроксид железа (III) — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании легко распадается на воду и соответствующий оксид.

Качественной реакцией на ионы Fe 3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий).
Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.

И еще одна качественная реакция на ионы Fe 3+ — взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок бурого цвета.
Соединения железа (VI) — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.

Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.

Основные степени окисления меди +1, +2.

Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит

Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди более активными металлами, например — железом.

Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
-
Реакции с неметаллами
Во влажном воздухе окисляется с образованием основного карбоната меди.
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)

Реакции с кислотами
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной — реакция идет.

Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
С оксидами неметаллов
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) CuO + S
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Оксид меди (I) окисляется кислородом до оксида меди (II).
Оксид меди (I) вступает в реакции с кислотами.
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
-
Реакции с кислотами
CuO + CO = Cu + CO2
Гидроксид меди (II) — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.

При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Реакции с кислотами
Реакции с щелочами
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Реакции с кислотными оксидами
Обратите особое внимание на реакцию взаимодействия соли меди (II) — сульфата меди (II), карбоната натрия и воды.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
Содержание:
Содержание
- Химические свойства щелочных металлов: взаимодействие, получение
- Химические свойства щелочноземельных металлов: взаимодействие, получение
- Химические свойства алюминия
- Химические свойства переходных металлов (меди, цинка, хрома, железа)
Химические свойства щелочных металлов: взаимодействие, получение
Щелочные металлы находятся в первой группе периодической таблицы. Атомы этих элементов содержат один электрон на внешнем энергетическом уровне. Он расположен на большом расстоянии от ядра. Как и все металлы являются восстановителями и легко отдают электрон. Характерна степень окисления равная +1. В группе сверху вниз наблюдается увеличение металлических свойств. За счет растущей энергии ионизации способность отдавать электроны, а следовательно, электроотрицательность возрастают снизу вверх.
Франций является самым активным металлом, так как у него электрон находится на самом далеком расстоянии от ядра. Соответственно, его способность к восстановлению самая высокая.

-
В нормальных условиях щелочные металлы взаимодействуют с кислородом. Они очень активны в таких реакциях, поэтому их хранят под слоем вазелинового масла. Продукты реакции могут быть оксидами или пероксидами.
Щелочные металлы вступают с водой в реакцию при нормальных условиях. Водород вытесняется из воды, и в качестве продукта реакции образуется растворимое основание – щелочь. Для распознавания щелочи можно использовать индикатор — фенолфталеин. При добавлении в раствор он окрашивается в малиновый цвет. Реакции с водой протекают очень бурно, литий «взрывается» в воде, натрий «кипит». При этом водород выделяется в виде белого пара клубами.
Вступают в реакции с галогенами, образуя галогениды.
2K + Cl2 → 2KCl
2Na + Cl2 → 2NaCl
Характерно взаимодействие с водородом при нагревании, продуктом реакции являются гидриды. Например, продуктом реакции калия и водорода будет гидрид калия.
С серой при нагревании образуют сульфиды. Это твердое, бесцветное вещество, растворимое в воде.
При нагревании происходит реакция с фосфором, фосфиды являются продуктом.
Литий и натрий могут вступать в реакцию с углеродом при нагревании. В результате образуются карбиды. Остальные щелочные металлы в эти реакции не вступают.
С азотом при обычных условиях реагирует только литий, с остальными щелочными металлами реакция возможна только при нагревании.
Взаимодействуют со спиртами, образуя алкоголяты.
Многие щелочные металлы способны взаимодействовать с разбавленными кислотами до образования водорода. Однако, реакция протекает стадийно, т.е. сначала металл реагирует с водой до образования щелочи, а затем происходит нейтрализация щелочи кислотой. Взаимодействие с кислотами сопровождается взрывом и поэтому такие реакции на практике не проводятся.
Получение
-
Основным методом получения щелочных металлов является электролиз галогенидных расплавов. При этом чаще всего используются хлориды, входящие в состав природных минералов.

Другими способами получения щелочных металлов могут быть получение из его оксидов и солей.
Например, натрий можно получить путем кальцинирования соды с углем.
Литий получают из его оксида при повышении температуры до 300°С.
Химические свойства щелочноземельных металлов: взаимодействие, получение
Главную подгруппу второй группы периодической системы химических элементов образуют металлы, которые получили название щелочноземельных. Так названы они потому, что гидраты их окислов («земель»), подобно гидратам окислов щелочных металлов, являются щелочами.
Внешний электронный слой их атомов состоит из двух электронов. Отдавая их, атомы этих металлов превращаются в ионы, несущие две единицы положительного заряда. Во всех своих соединениях металлы подгруппы бериллия положительно двухвалентны. В периодической таблице они соседствуют с щелочными металлами. Поэтому эти элементы проявляют высокую химическую активность, уступая в ней только щелочным металлам. Свойства металла повышаются с увеличением порядкового номера.

-
Вступают в реакции с кислородом, продуктом реакции становятся оксиды, исключение барий, он образует пероксид BaO2. Бериллий и магний взаимодействуют с кислородом только при очень высоких t, так как покрыты тонкой защитной оксидной пленкой.
В приведенной выше реакции кусочек кальция сгорает с образованием белого дыма при нагревании. Он образован тончайшими твердыми частицами оксида кальция.
Подобно щелочным металлам взаимодействуют с водой, но менее активно. В результате образуется гидрат оксида и вытесняется водород.
Фенолфталеин окрашивается в полученном растворе в малиновый цвет. Этот пример оправдывает ожидаемое сходство в химических свойствах щелочноземельных и щелочных металлов: оба взаимодействуют с водой с выделением водорода. Гидраты оксидов щелочноземельных металлов, как и щелочи, являются щелочами, то есть они растворимы в воде.
Все металлы, кроме бериллия, вступают в реакцию с галогенами. Бериллий взаимодействует с галогенами только при повышенных температурах. Продуктом реакции являются галогениды.
При нагревании с водородом реагируют все щелочноземельные металлы, кроме бериллия. В результате образуются гидриды.
Реагируют с серой, в результате чего образуются сульфиды.
Взаимодействуют с азотом при нагревании, за исключением магния. Он реагирует с азотом в нормальных условиях. Продуктом реакции являются нитриды.
Могут вступать в реакции с кислотами, в результате образуют соли соответствующей кислоты и водород.
Получение
Основными способами получения металлов второй группы главной подгруппы являются электролиз расплавов, алюминотермия и вытеснение из их солей другими более активными металлами.

Химические свойства алюминия
Алюминий находится в третьей группе периодической системы элементов. Заряд ядра атома алюминия +13, на внешнем электронном слое три электрона.
По строению атомов и положению в периодической системе можно предположить, что у элементов третьей группы металлические свойства должны быть выражены слабее, чем у элементов второй группы. Это действительно так.
При химических реакциях атом алюминия отдает три электрона внешнего слоя, обращаясь в трех зарядный положительный ион Al 3+ . Поэтому во всех его устойчивых соединениях алюминий положительно трехвалентен. Его соединения проявляют амфотерные свойства.

Алюминий – химически активный металл и проявляет себя как восстановитель. Однако его активность снижает оксидная пленка, которая образуется на его поверхности. Поэтому во многих реакциях пленка сначала удаляется, а затем осуществляется взаимодействие с веществами. Рассмотрим на конкретных примерах химические свойства алюминия.
-
Алюминий соединяется с кислородом воздуха и при нагревании и при обыкновенной температуре. На его поверхности быстро образуется тончайшая плотная пленка окиси алюминия. Она трудно проницаема для газов и защищает металл от дальнейшего окисления.
В раздробленном состоянии и при повышенной температуре алюминий бурно реагирует с кислородом с выделением большого количества тепла. В результате образуется окись алюминия.
Со многими неметаллами реакции происходят при нагревании.
С водой взаимодействует при удалении оксидной пленки. Реакция протекает энергично, вытесняя водород из воды.
Взаимодействие с кислотами. Опустим алюминиевые стружки в пробирку с соляной или разбавленной серной кислотой. Алюминий растворяется, вытесняя из кислоты водород и образуя соль.
С концентрированной азотной и серной кислотой не реагирует. Поэтому концентрированная азотная кислота хранится в алюминиевых емкостях и транспортируется в алюминиевых резервуарах.
С разбавленной азотной кислотой вступает в реакцию с образованием
Поскольку алюминий обладает амфотерными свойствами, он характеризуется реакциями со щелочами.
Алюминий взаимодействует с окислами большинства металлов, вытесняя менее активный металл. Этот метод используется в промышленности для получения металлов и называется алюминотермией.
Химические свойства переходных металлов (меди, цинка, хрома, железа)
Переходные элементы – металлы, расположены в побочных подгруппах периодической системы химических элементов. Так как у них происходит заполнение d-уровней в последнюю очередь, то их относят к d-элементам. Если последним заполняется f-уровень, то это f-элементы. Соответственно, химические свойства обусловлены таким строением атома. Рассмотрим химические свойства некоторых переходных элементов. У всех переходных элементов наблюдается так называемый «проскок электрона», т.е. электрон может переходить на соседнюю орбиталь в пределах одного электронного слоя.



- Взаимодействие с кислородом
- В кислороде железо сгорает, разбрасывая искры – раскаленные капли железной окалины, а при накаливании на воздухе окисляется с поверхности, образуя окалину в виде корки. Во всех случаях образуется железная окалина. 3Fe + 2O2 → Fe3O4
- Медь, цинк и хром вступают в реакцию с кислородом только при нагревании

2Zn + O2 → 2ZnO
4Cr + 3O2 → 2Cr2O3
Взаимодействие с неметаллами.
-
Железо способно реагировать с азотом, фосфором, углеродом и серой. Энергично реагирует при нагревании с серой, образуя сернистое железо.
Медь не реагирует с водородом, азотом, углеродом и кремнием. Характерны реакции с серой при нагревании.
При нагревании цинк взаимодействует с серой и фосфором. С водородом, азотом, бором, кремнием, углеродом цинк в реакции не вступает.
Хром взаимодействует с азотом, серой, бором, углеродом и кремнием при повышенных температурах.
Взаимодействие с галогенами
-
Железный порошок, предварительно нагретый и внесенный в колбу с хлором, сгорает, образуя бурый дым – хлорное железо.
Медь и хром с галогенами вступает в реакции при нагревании.
Цинк вступает в реакции с галогенами при нормальных условиях, в качестве катализатора необходимы пары воды.
При нагревании характерно взаимодействие с водой железа, цинка, хрома. Медь неактивный металл, поэтому с водой не реагирует.
При обычных условиях железо реагирует с парами воды и кислородом. Происходит процесс ржавления и образуется желто-бурая ржавчина – гидрат окиси железа.
Защита меди от коррозии – лучшие методы
 Как быстро ржавеет медь и что с этим делать
Как быстро ржавеет медь и что с этим делать
Медные изделия применяются людьми на протяжении многих веков. Даже в древнейшие времена стоимость такого металла могла приравниваться к стоимости золота, так как производства данного металла было очень дорогостоящим.
На данный момент медь стала куда дешевле, и потому из нее, помимо украшений, стараются делать посуду, аксессуары в интерьер и остальные предметы. Не задумывались ли над тем, как быстро ржавеет медь?
Коррозия меди, в отличия от того же железа, развивается крайне медленно за счет ее устойчивости к такому явлению, и все же иногда требуется принимать меры по очищению изделий от ужасного налета.
Коррозия металлов/сплавов – что это
Под ржавлением подразумевается процесс разрушения металла под воздействием негативных факторов в окружающей среде. В той или иной мере будут ржаветь все металлы, сплавы, и в результате этого на них появляется ржавчина и места ухудшения целостности (а именно, дыры). Со временем могут начать портиться все неметаллы – примером можно называть старение резины или даже пластика от воздействия с кислородом, при постоянном контакте с водой, а еще из-за температурных перепадов.
Главной первопричиной ржавления можно считать термодинамическую неустойчивость металла к воздействию факторов физического типа или даже веществ химического происхождения, которые есть в контактной среде. В сравнении с железом медь будет окисляться куда меньше, но при увеличении температуры такой процесс будет сильно ускоряться. При регулярном нахождении в среде при температуре выше +105 градусов любой металл будет ржаветь в несколько раз быстрее.
Подробности
Коррозионные качества
Медь представляет собой металл с высокими свойствами пластичности, которые имеют красновато-золотистый цвет, а после снятия оксидной пленки немного розоватым. По электрической проводимости он будет уступать только серебру, еще характеризуется огромной степенью тепловой проводимости. За счет низкого удельного сопротивления медь используется в электротехнике – она идет на изготовление пластинок из меди, обмотки электрической двигателей, проволоки.
Обратите внимание, что из-за прекрасных антикоррозионных свойств металл будет включаться в сплавы для усовершенствования их инженерных характеристик (латунь, бронза и прочие). В гальванической среде медь превращается в катод, и начинает вступать в электрохимические процессы, а еще вызывает ускоренный процесс ржавления остальных металлов.
Медь является неактивным химическим элементов, и потому она практически не взаимодействует с водой (морской или пресной), воздухом. Если воздух сухой, на поверхность материала будет формироваться оксидная пленка с толщиной до 50 мн. Изделие из меди начинает темнеть, становится зеленоватым или коричневым, и это называется патиной. Во множестве случаев патина воспринимается, как покрытие декоративного типа. Коррозионная интенсивность мала при контактировании с разведенной соляной кислотой, но при реакции со множеством остальных кислот, с галогенами, «царской водкой» металл будет окислен с образованием медного карбоната.
Условия для разрушения меди
Несмотря на стойкости к порче, даже изделия из меди при определенных условиях способны ржаветь. Меньше всего такие явления выражены в воде, влажном воздухе, почве и даже больше – в среде кислого типа. Ощутимо уменьшать коррозию можно посредством лужения – покрытия меди оловянным слоем. Качественный процесс лужения дает надежность и защиту от дефектов, а еще повышает устойчивость к коррозии, делает материал не подверженным воздействию высокой температуры, града, дождя и снега. Срок применения луженых изделий будет составлять больше сотни лет без потери первозданных качеств.
Воздействие воды
 Защита меди от коррозии очень важна. Скорость ржавления меди в воде будет сильно зависеть от наличия пленки оксидного типа на ее поверхности, а также от уровня насыщенности воды посредством кислорода. Чем больше кислорода в воде, тем интенсивнее будет протекать разрушение материала. В целом же, медь можно считать устойчивой к вредоносному воздействию пресной и соленой воды, и негативно воздействуют на нее лишь растворенные хлорные ионы, а еще низкая степень рН. Прочность, а также неподверженность ржавлению дает возможность применять материалы для изготовления трубопровода.
Защита меди от коррозии очень важна. Скорость ржавления меди в воде будет сильно зависеть от наличия пленки оксидного типа на ее поверхности, а также от уровня насыщенности воды посредством кислорода. Чем больше кислорода в воде, тем интенсивнее будет протекать разрушение материала. В целом же, медь можно считать устойчивой к вредоносному воздействию пресной и соленой воды, и негативно воздействуют на нее лишь растворенные хлорные ионы, а еще низкая степень рН. Прочность, а также неподверженность ржавлению дает возможность применять материалы для изготовления трубопровода.
Обратите внимание, что, если на поверхности изделия, которое покрыто посредством меди, имеет зеленая или даже коричневая оксидная корочка, разрушающие компоненты в малой степени будут проникать внутрь. Как правило, слой оксида образуется спустя 2 месяца нахождения металла в воде. Намного прочнее будет считаться зеленая корочка (то есть карбонатная), рыхлой и не такой крепкой – черная (сульфатная).
В воде из моря степень коррозии почти такой же, как и в обычной, то есть пресной. Лишь при ускорении передвижения воды ржавление станет ударным, и потому более интенсивным. Медь является материалом, который не может обрастать морскими микроскопическими организмами, потому что его ионы губительные для водорослей и моллюсков. Такое свойство металла применяется в судоходстве, а также в рыбном хозяйстве.
Влияние щелочей и кислот
В щелочах медь не будет портиться, потому что материал сам по себе является щелочным, зато кислоты для нее будут являться самыми негативными по воздействию. Самая быстрая и значимая коррозия будет происходить при контактировании с серой и ее кислотными типами соединений, а азотная кислота способна полностью разрушать структуру материала. В концентрированной кислоте медь начинает растворяться, и потому при изготовлении оборудования для промышленности нефтегазового типа требуется дополнительная защита.
С такой целью применяют ингибиторы – замедлители химической реакции:
- Экранирующие – создают пленку, которая не дает кислотам достигать медной поверхности.
- Окислительные – помогают превратить верхний слой в окись, которая начнет вступать в реакцию с кислотами без вреда непосредственно для самого металла.
- Катодные – увеличивают катодное перенапряжение, чем замедлят реакцию.
Рассмотрим еще кое-что, касающееся коррозии
Коррозия от влажного воздуха и почвы
В почве проживает большое количество микроскопических организмов, которые способны вырабатывать сероводород, так как среда тут кислая, а скорость коррозии меди возрастет. Чем больше отклонение значения рН в стороне окисления, тем скорее будут протекать разрушительные процессы. Если почва оснащена кислородом, то металл начинает окисляться, но ржаветь будет меньше. При длительном нахождении изделий из меди в земле они начинают зеленеть, становятся рыхлыми и способны даже рассыпаться. Краткосрочное пребывание в грунте вызывает образование патины, от которой предмет можно очищать. Кстати, влажный воздух способен плохо сказываться на состоянии материала лишь при длительном контакте, а для начала тоже вызывает образование патины (оксидного слоя). Исключение будет составлять пар, который насыщенный сульфидами, хлоридами, углекислотой – в нем коррозия будет развиваться стремительнее.
Почему медные изделия требуется регулярно очищать?
Ковши из меди, турки, самовары отличаются высокой степенью тепловой проводимости, и потому нагревание в них протекает равномерно, а продукты будут приготовлены быстрее. Это обусловлено высокую популярность изделий в быту. Потребность в очистке медных предметов обусловлено утратой ими визуальной привлекательности спустя время. Особенно быстро начинают тускнеть и теряют естественный цвет изделия, которые находятся на воздухе или даже часто нагревающиеся.
Коррозия меди в виде оксидной пленки (патины) популярна лишь в тот момент, где требуется придание предметам винтажного облика, стилизация под старину. В обратном случае она будет портиться внешний вид посуды, утвари, а также статуэток и украшений. Чтобы устранять оксидный налет, элементы потемнения и вернуть прежний блеск, требуется время от времени чистить предметы. Также очищение требуется для того, чтобы исключить попадания в пищу вредоносных соединений, которые способы присутствовать в зеленом и черном слое.
Эффективные способы очистки меди
Произвести очищение медных предметов несложно, для этого не требуются дорогостоящие средства. Вот наиболее популярные методики, которые используют в домашних условиях:
 Кетчуп – возьмите немного кетчупа из томатов, смажьте им изделие и оставьте на пару минут. После сполосните струей чистой и прохладной воды.
Кетчуп – возьмите немного кетчупа из томатов, смажьте им изделие и оставьте на пару минут. После сполосните струей чистой и прохладной воды.- Раствор для мытья посуды – следует намылить хозяйственную губку простым средством для посуды, тщательно протирайте поверхность и смывайте водой. такой метод лучше всего подойдет для изделий, которые лишь слегка потускнели.
- Лимон – следует натереть медную поверхность лимонной долькой, а после пройдитесь по нему щеточкой с жесткими ворсинками и помойте водой.
- Мука и уксус – влейте в чашку малое количество, добавьте муки до получения теста со средней густотой. Смажьте медное изделие посредством теста, оставьте до просыхания, а после удалите остатки. После остается натереть изделия мягкой тряпкой.
- Соль и уксус – налейте в кастрюльку из нержавеющей стали уксус 9%, всыпьте немного соли и доведите до кипения. Огонь следует выключить, закинуть в раствор предмет из меди, не убирать его до остывания жидкости. Данный способ подойдет для очень загрязненных поверхностей.
А теперь рассмотрим, как чистить медные монеты.
Очистка медных монет
Именно монетки из меди представляют собой антиквариат, и в наше время не будут выпускаться. Нередко требуется их очищать, чтобы вернуть красивый внешний вид. Если монета из меди контактировала со свинцом, налет на ней бывает желтоватым. В этом случае он будет прекрасно очищаться посредством столового уксуса (9%). Зеленый налет следует убрать посредством раствора лимонной кислоты (10%) или даже лимонным натуральным соком, коричневый аммиаком или углекислым аммонием.
Следует помнить о том, что иногда слой патины помогает придавать монетам более винтажный и благородный внешний вид, и потому удалять его стоит не всегда. Некоторые де стараются искусственно состарить деньги домашним методом. Для этого возьмите литр дистиллированной воды, 5 грамм марганцовки (аптечной) и 50 грамм медного купороса. Раствор следует нагреть, не доводя до кипения, бросить в него монеты, оставить до получения требуемого оттенка. Для закрепления полученного эффекта просохшие деньги обработайте все смесью спирта и бензола (1 к 1). После монеты обретают красивый состаренный вид и способны украшать любые коллекции антикварных предметов.
Взаимодействует ли медь с водой
All Metals
Металлы и Металлургия
Алюминий
Ванадий
Вольфрам
Германий
Железо
Золото
Кобальт
Магний
Марганец
Медь
Молибден
Никель
Ниобий
Олово
Палладий
Платина
Плутоний
Свинец
Серебро
Тантал
Титан
Уран
Хром
Цинк
Цирконий
- Металлургия России
- О металлах
- Медь
- Химические свойства
Химические свойства
Химическая активность меди невелика. В сухой атмосфере медь практически не изменяется. Во влажном воздухе на поверхности меди в присутствии углекислого газа образуется зеленоватая пленка состава Cu(OH)2·CuCO3. Так как в воздухе всегда имеются следы сернистого газа и сероводорода, то в составе поверхностной пленки на металлической меди обычно имеются и сернистые соединения меди. Такая пленка, возникающая с течением времени на изделиях из меди и ее сплавов, называется патиной. Патина предохраняет металл от дальнейшего разрушения.
При нагревании на воздухе медь тускнеет и в конце концов чернеет из-за образования на поверхности оксидного слоя. Сначала образуется оксид Cu2O, затем — оксид CuO.
В сухом воздухе и кислороде при нормальных условиях медь не окисляется. Но она достаточно легко вступает в реакции: уже при комнатной температуре с галогенами, например с влажным хлором образует хлорид CuCl2, при нагревании с серой образует сульфид Cu2S, с селеном. Но с водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах. Кислоты, не обладающие окислительными свойствами, на медь не действуют, например, соляная и разбавленная серная кислоты. Но в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соответствующих солей:
Кроме того, медь можно перевести в раствор действием водных растворов цианидов или аммиака:
При нагревании металла на воздухе или в кислороде образуются оксиды меди: желтый или красный Cu2O и черный CuO. Повышение температуры способствует образованию преимущественно оксида меди(I) Cu2O. В лаборатории этот оксид удобно получать восстановлением щелочного раствора соли меди(II) глюкозой, гидразином или гидроксиламином:
Эта реакция – основа чувствительного теста Фелинга на сахара и другие восстановители. К испытываемому веществу добавляют раствор соли меди(II) в щелочном растворе. Если вещество является восстановителем, появляется характерный красный осадок.
Поскольку катион Cu+ в водном растворе неустойчив, при действии кислот на Cu2O происходит либо дисмутация, либо комплексообразование:
Оксид Cu2O заметно взаимодействует со щелочами. При этом образуется комплекс:
Оксиды меди не растворимы в воде и не реагируют с ней. Единственный гидроксид меди Cu(OH)2 обычно получают добавлением щелочи к водному раствору соли меди(II). Бледно-голубой осадок гидроксида меди(II), проявляющий амфотерные свойства (способность химических соединений проявлять либо основные, либо кислотные свойства), можно растворить не только в кислотах, но и в концентрированных щелочах. При этом образуются темно-синие растворы, содержащие частицы типа [Cu(OH)4] 2– . Гидроксид меди(II) растворяется также в растворе аммиака:
Гидроксид меди(II) термически неустойчив и при нагревании разлагается:
Большой интерес к химии оксидов меди в последние два десятилетия связан с получением высокотемпературных сверхпроводников, из которых наиболее известен YBa2Cu3O7. В 1987 было показано, что при температуре жидкого азота это соединение является сверхпроводником. Главные проблемы, препятствующие его широкомасштабному практическому применению, лежат в области обработки материала. Сейчас наиболее перспективным считается изготовление тонких пленок.
Многие из халькогенидов меди – нестехиометрические соединения. Сульфид меди(I) Cu2S образуется при сильном нагревании меди в парах серы или в среде сероводорода. При пропускании сероводорода через водные растворы, содержащие катионы Cu 2+ , выделяется коллоидный осадок состава CuS. Однако, CuS – не простое соединение меди(II). Оно содержит группу S2 и лучше описывается формулой Cu I 2Cu II (S2)S. Селениды и теллуриды меди проявляют металлические свойства, а CuSe2, CuTe2, CuS и CuS2 при низких температурах являются сверхпроводниками.
Практическое значение имеет способность меди реагировать с растворами солей железа (III), причем медь переходит в раствор, а железо (III) восстанавливается до железа (II):
Этот процесс травления меди хлоридом железа (III) используют, в частности, при необходимости удалить в определенных местах слой напыленной на пластмассу меди.
Ионы меди Cu 2+ легко образуют комплексы с аммиаком, например, состава [Cu(NH3)] 2+ . При пропускании через аммиачные растворы солей меди ацетилена С2Н2 в осадок выпадает карбид (точнее, ацетиленид) меди CuC2.