Самый плавкий металл
Самый плавкий металл
Самый легкоплавкий металл
Каждый человек множество раз держал в руках самый легкоплавкий металл, причём без всяких последствий. Речь идет о ртути, грозном и загадочном элементе из подгруппы цинка, занимающем в периодической таблице атомный номер 80.
Общие сведения
Название переводится с греческого, как «серебряная вода». На латинском звучит как hydrargyrum, а в русском это толкование праславянского — «катиться». Первая цивилизация шумеров уже вовсю использовала ртуть. Металл добывали из киновари (сульфида ртути) просто обжигая руду, или же из пород, где его видно в виде небольших вкраплений.
Это редкий элемент — общая доля в земных недрах составляет всего 83 мг на одну тонну, причем чаще в рассеянной форме, чем в виде месторождений. Больше всего ее содержится в сульфидах и сланцах, а всего в мире имеется более 20 минералов со ртутью.

Самый легкоплавкий металл
Это единственный из металлов, который может находиться в жидком состоянии при обычной температуре. Такой же и бром, только он относится к галогенам. Твердеет ртуть (и плавится) при -39 °С.
Всего 7 металлов плавятся при минусовой температуре. Литр ртути очень тяжелый — 13,5 кг, а закипит она при +357°С.

Ртуть в природе
Интересно что доказательства ее принадлежности к металлам были опубликованы только в середине XVIII века Брауном и Ломоносовым. Они смогли заморозить ртуть и убедиться в ее металлических свойствах: ковкости, электропроводности, расширении при нагреве.
Самый токсичный металл
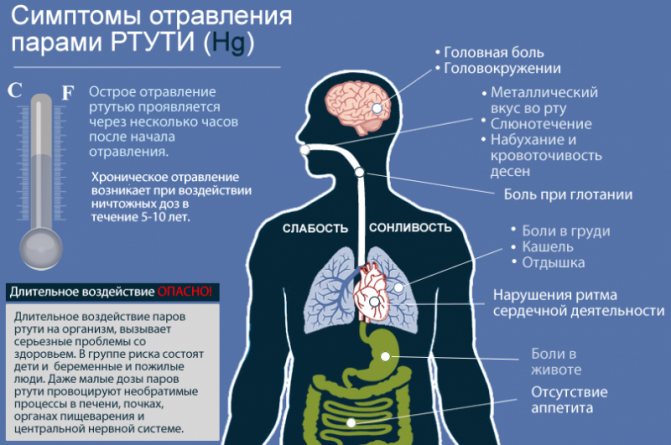
Ртути принадлежит высочайшая степень токсичности. Это самый ядовитый из всех нерадиоактивных элементов на планете, который начинает распространять свои пары при комнатной температуре. Если рядом присутствует человек, происходит поражение пищеварения, легких и нервной системы, причём первые признаки интоксикации наступают очень быстро, через 8 часов.
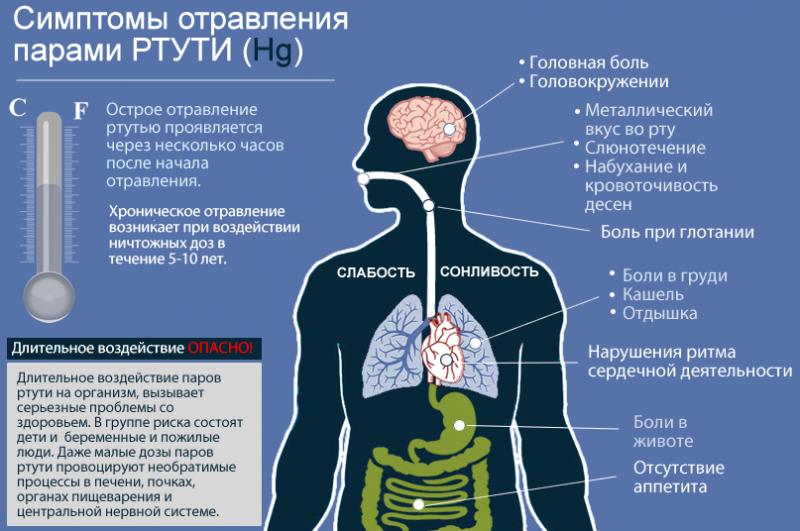
Симптомы отравления ртутью
И даже воздействие небольших доз, но длительный период, способно проявить себя в виде хронических заболеваний. Нервная система в первую очередь реагирует раздражением, недосыпанием, головными болями и быстрой усталостью. Выводится ртуть через почки. Начинаются частые позывы к мочеиспусканию, повышение температуры, рвота, слабость, тошнота, дрожь в теле.
Самая известная экологическая трагедия XX века, болезнь Минамата, вызвана отравлением метилртутью. Промышленное загрязнение бухты этого японского города в 1956 году привело к 3 тыс. жертв.
Люди всегда знали о токсических свойствах ртути. Например, при изготовлении фетровых шляп использовались ртутные соединения, но другого способа тогда не было. У мастеров часто развивались поражения нервной системы и слабоумие. Поэтому безумный Шляпник, описанный Льюисом Кэрроллом в «Алисе в стране чудес», совсем не выдуманный персонаж.

Безумный Шляпник из “Алисы в стране чудес”
В обычной жизни пищевые отравления грозят любителям морепродуктов. Ртуть содержится и растворяется в морской воде, накапливаясь в организмах его обитателей.
Симптомы хронического отравления часто встречаются в прибрежных районах по всему миру. Особенно страдают беременные и дети, у которых это основная пища. Умеренная олигофрения диагностируется там намного чаще, чем у тех групп, где морская рыба не является основным источником питания.
Хищники, поедая мелочь, сохраняют и приумножает отраву в своих организмах. У каждой четвертой выловленной рыбы содержание металла превышает допустимые пределы. Особенно много его в тунце и лобстере. Экологи бьют тревогу, а компании по производству рыбных продуктов открещиваются. И никакая тепловая обработка не делает мясо менее токсичным.
Использование самого легкоплавкого металла в быту
Несмотря на токсичность, человечество до сих пор не может отказаться от ртути.
Хорошая электропроводимость делает ее незаменимой в энергосберегающих лампах, паровых турбинах, вакуумных и диффузных насосах. Умение реагировать на малейшие колебания температуры и давления используется в барометрах и термометрах.
Батарейки, энергосберегающие лампы, аккумуляторы, контакты выключателей — везде содержится этот высокоионизированный металл. В градуснике находится от 1 до 2 гр этого металла (в стандартных российских 1 гр). Но и эти несколько граммов полностью испарятся из помещения только в течение 20 лет. При концентрации менее 0,25 мгм3 ртуть оседает в легких. При более высоких дозах организм начинает впитывать яд через кожу. Мужчины менее чувствительны к парам, чем дети и женщины.

Вы можете найти ртуть в холодильнике, стиральной машине и кондиционере. Сельское хозяйство чаще всего использует соли ртути в составе пестицидов. Взрывчатка содержит фульминат ртути, антисептики — сульфат.

Фульминат ртути (взрывчатое вещество)
Не могут отказаться от ртути при окрашивании бортов корабля. Морские микроорганизмы всегда селятся там и существенно разрушают обшивку. Только краска на основе «серебряной воды» помогает сохранить судно.
 Покраска судна
Покраска судна
Человечество с самых древних времен использовало ртуть для добычи из руды драгоценных металлов. Ртуть создает сплавы со всеми металлами (амальгамация) и только благодаря ей добыча серебра и золота в Мексике конкистадорами, начиная XVI века, достигла таких впечатляющих размеров и изменила весь мир.

Добыча золота ртутью
Никогда ртуть не транспортируют в самолетах, причем дело не в токсичности. Ртуть хорошо вступает в контакт со всеми металлами, делая их ломкими. Особенно это касается алюминиевых сплавов — случайная авария может повредить самолет.
Использование самого легкоплавкого металла в медицине
Ядовитый металл чаще всего встречался в эликсирах бессмертия и лекарствах для продления жизни. Алхимики пробовали добывать золото прямо из ртути, только сначала ее надо было нагреть. Ртуть называли праматерью металлов, она входила в теорию трех начал (с серой и солью) и была основным элементом философского камня.
 Ртуть
Ртуть
Даже магические действия шаманов не могли обойтись без ртути. Распыляемым порошком киновари отпугивали нечистых духов. Несмотря на токсичность, «серебряную воду» активно использовали древние врачи практически во всех сферах своей деятельности.
Древнеегипетские жрецы клали немного ртути в сосуд и помещали в горло фараона, чтобы обезопасить его в загробной жизни.
В Индии йоги пили ртутно-серный напиток и утверждали, что таким образом можно продлить жизнь. Одним из самых вопиющих случаев в древности было лечение заворота кишок с помощью данного химического элемента.
Врачи были уверены, что жидкое серебро должно замечательно проходить сквозь человеческие кишки, распрямляя их. Но данный способ почему-то не прижился, так как у пациентов от большого объема высокоплотного «лекарства» происходил разрыв желудка.
Утверждают, что Иван Грозный стал жертвой именно ртути. Предположительно, ему или лечили сифилис, или давали лекарства, содержащие ртуть. То, что русский царь умер в результате ртутной интоксикации и имел деформации костей, свойственные глубоким старикам, уже доказано несколькими учеными.
 Иван Грозный
Иван Грозный
Историки отмечали, что перед смертью царь очень изменился. Постоянная свирепость, искаженные черты лица, на теле не осталось ни единого волоса. Постоянные эпилептические припадки служили очередным доказательством отравления.
Интересно, что мгновенно покончить с жизнью с помощью ртути ни у кого не получалось. Когда самоубийцы выпивали металл — все они выживали. Самыми опасными являются пары и раствор, а сама ртуть никогда не растворится в желудке и выйдет из организма.
В 70-х годах в продаже можно было встретить множество препаратов с ртутью: мочегонные, слабительные, в мазях для отбеливания лица и антисептиках.
Амальгама серебра не так давно была распространенным пломбировочным стоматологическим материалом в России и до сих пор используется в дешевых пломбах за рубежом.
 Пломба из амальгамы
Пломба из амальгамы
Самый легкоплавкий металл на планете необходим человечеству по-прежнему. А вот смогут ли люди дружить с ним, не отравляя жизнь вокруг — очень спорный вопрос…
Самый легкоплавкий металл
Вместо заключения
Примерно тридцать тысяч тонн в год вольфрама производится во всем мире. Этот металл непременно входит в состав наилучших сортов сталей для изготовления инструментов. На нужды металлургии расходуется до 95% всего вырабатываемого вольфрама. Для удешевления процесса в основном используют более дешевый сплав, состоящий из 80% процентов вольфрама и 20% железа. Используя свойства вольфрама, его сплав с медью и никелем применяют для производства контейнеров, используемых под хранение радиоактивных веществ. В радиотерапии этот же сплав служит для изготовления экранов, обеспечивая надежную защиту.
Виды металлов и сплавов, обладающие устойчивостью к повышенным температурам:
- Вольфрам. Впервые о нем узнали в 1781 году. Чтобы расплавить, его потребовалось разогреть до 3380 градусов. Вольфрам считается самым тугоплавким. Изготавливается он из порошка, который обрабатывается химическим способом. Сначала смесь разогревается, а затем подвергается давлению. На выходе получаются спрессованные заготовки.
- Ниобий. Плавится при 2500 градусах. Обладает высокой теплопроводностью, обрабатывается не так сложно, как вольфрам. Изготавливается из порошка, который запекают и обрабатывают с помощью высокого давления. Из ниобия делают проволоку, трубы и ленту.
- Молибден. Визуально его можно спутать с вольфрамом. Изготавливается он из порошка при запекании и воздействии давлением. Как и вольфрам обладает парамагнетическими свойствами. Используется в радиоэлектронике, изготовлении промышленного оборудования, печей и электродов.
- Тантал. Плавится при 3000 градусах. Чтобы сделать проволоку из тантала или закалить материал, его не нужно нагревать до критических температур. Используется для изготовления элементов в радиоэлектронике (конденсаторы, пленочные резисторы). Популярен в ядерной промышленности.
- Рений. Материал, который ученые открыли позже остальных. Найти его можно в медной и платиновой руде. Используется на промышленном производстве, как легирующая добавка.

Тантал
Суть понятия самого легкоплавкого металла
Для специалистов больше знакомо понятие «тугоплавкость». Хотя слово «легкоплавки» и является антонимом в языковом аспекте, на практике – это один из пунктов к общей классификации в промышленности. По своей сути, любой элемент, имеющий температуру плавления менее 600 градусов по Цельсию, называют легкоплавким. Некоторые источники ставят планку вхождения в группу еще ниже – до 500 градусов Цельсия.
Классификация металлов по плавкости:
- легкоплавкие. Температура плавления элементов обязана быть ниже 600 градусов по Цельсию;
среднеплавкие металлы. Чтобы материал расплавился, потребуется температура от 600 до 1600 градусов со значением плюс;
тугоплавкие. Металлические вещества с порогом плавления выше 1 600 градусов по Цельсию.
Процесс плавления одинаковый для всех металлических элементов – либо внешнее воздействие, либо внутреннее. В первом случае – это расплавка в печах, а во втором – разогревание через пропуск электрического тока сквозь металл. Иногда используется индукционный нагрев в электромагнитном поле с высокой частотой.
Процесс плавки металла через призму науки:
- Разогрев до температуры плавления.
- Увеличение амплитуды тепловых колебаний молекул внутри металла.
- Возникновение дефектов в структуре решетки материала.
- Межатомные связи разрываются + параллельно затрачивается энергия.
- Образование на поверхности квазижидкого слоя.
- Постепенное разрушение решетки и накопление дефектов, что и принято называть процессом плавления.
В зависимости от температуры плавления, выбирают аппараты из сплавов, способных выдержать пиковые значения. Для легкоплавких металлов вопрос решается проще всего.
Второй весомый параметр – температура кипения металла. В 95% случаев она в 2 раза выше температуры плавления. Между собой эти две величины являются прямо пропорциональными + при снижении/увеличения давления на материал, снижается и его показатели плавления с кипением.
Самый токсичный металл
Ртути принадлежит высочайшая степень токсичности. Это самый ядовитый из всех нерадиоактивных элементов на планете, который начинает распространять свои пары при комнатной температуре. Если рядом присутствует человек, происходит поражение пищеварения, легких и нервной системы, причём первые признаки интоксикации наступают очень быстро, через 8 часов.
Симптомы отравления ртутью
И даже воздействие небольших доз, но длительный период, способно проявить себя в виде хронических заболеваний. Нервная система в первую очередь реагирует раздражением, недосыпанием, головными болями и быстрой усталостью. Выводится ртуть через почки. Начинаются частые позывы к мочеиспусканию, повышение температуры, рвота, слабость, тошнота, дрожь в теле.
Люди всегда знали о токсических свойствах ртути. Например, при изготовлении фетровых шляп использовались ртутные соединения, но другого способа тогда не было. У мастеров часто развивались поражения нервной системы и слабоумие. Поэтому безумный Шляпник, описанный Льюисом Кэрроллом в «Алисе в стране чудес», совсем не выдуманный персонаж.

Безумный Шляпник из “Алисы в стране чудес”
В обычной жизни пищевые отравления грозят любителям морепродуктов. Ртуть содержится и растворяется в морской воде, накапливаясь в организмах его обитателей.
Симптомы хронического отравления часто встречаются в прибрежных районах по всему миру. Особенно страдают беременные и дети, у которых это основная пища. Умеренная олигофрения диагностируется там намного чаще, чем у тех групп, где морская рыба не является основным источником питания.
Болезнь Минамата
Хищники, поедая мелочь, сохраняют и приумножает отраву в своих организмах. У каждой четвертой выловленной рыбы содержание металла превышает допустимые пределы. Особенно много его в тунце и лобстере. Экологи бьют тревогу, а компании по производству рыбных продуктов открещиваются. И никакая тепловая обработка не делает мясо менее токсичным.
Применение
Изначально тугоплавкие металлы использовались при изготовлении конденсаторов и транзисторов для радиоэлектроники. Количество их сфер применения увеличилось только к середине 20 века. Промышленной комплекс расширился до изготовления деталей для станков, автомобилей, самолётов и ракет.
Сплавы, выдерживающие воздействие критических температур, начали использоваться для изготовления посуды. Тугоплавкие металлы применяются в процессе производства строительных и соединительных материалов. Из них делают детали для бытовых приборов и электроники.
Самым тугоплавким считается вольфрам. Его температура плавления в 3390 градусов превышает показатели других материалов. Однако нельзя забывать про то, что при падении вольфрамовой детали с высоты, она треснет или разобьётся на отдельные части.
Области применения
До середины 40-х годов тугоплавкие металлы использовались только как легирующие элементы для улучшения механических характеристик стальных цветных сплавов на основе меди и никеля в электропромышленности. Соединения молибдена и вольфрама применялись также в производстве твердых сплавов.
Техническая революция, связанная с активным развитием авиации, ядерной промышленности и ракетостроения, нашла новые способы использования тугоплавких металлов. Вот неполный перечень новых сфер применения:
- Производство тепловых экранов головного узла и каркасов ракет.
- Конструкционный материал для сверхзвуковых самолётов.
- Ниобий служит материалом сотовой панели космических кораблей. А в ракетостроении его используют в качестве теплообменников.
- Узлы термореактивного и ракетного двигателя: сопла, хвостовые юбки, лопатки турбин, заслонки форсунок.
- Ванадий является основой для изготовления тонкостенных трубок тепловыделяющих элементов термоядерного реактора в ядерной промышленности.
- Вольфрам применяется как нить накаливания электроламп.
- Молибден все шире и шире используется в производстве электродов, применяемых для плавки стекла. Помимо этого, молибден — металл, используемый для производства форм литья под давлением.
- Производство инструмента для горячей обработки деталей.
Рейтинг: /5 —
голосов
Разногласия в критическом параметре
Одни источники устанавливают пороговую величину как 4000 F. В переводе на привычную шкалу это дает 2204 0С. Согласно этому критерию, к жаропрочным относятся только пять элементов: вольфрам, ниобий, рений, тантал и молибден. Например, температура плавления вольфрама составляет 3422 0С.
Видео – плавка вольфрама водородной горелкой
Другое утверждение позволяет расширить класс температуростойких материалов, поскольку принимает за точку отсчета температуру плавления железа – 1539 0С. Это позволяет увеличить список еще на девять элементов, включив в него титан, ванадий, хром, иридий, цирконий, гафний, родий, рутений и осмий.
Существует еще несколько пороговых величин температуры, однако они не получили широкого распространения.
Сплавы
Чтобы изменить свойства того или иного металла, его сплавляют с другими веществами. Так, он может не только приобрести большую плотность, прочность, но и снизить или повысить температуру плавления.
Сплав может состоять из двух или больше химических элементов, но хотя бы один из них должен быть металлом. Такие «смеси» очень часто используют в промышленности, ведь они позволяют получить именно те качества материалов, которые необходимы.

Температура плавления металлов и сплавов зависит от чистоты первых, а также от пропорций и состава вторых. Для получения легкоплавких сплавов чаще всего используют свинец, ртуть, таллий, олово, кадмий, индий. Те, в составе которых находится ртуть, называются амальгамами. Соединение натрия, калия и цезия в соотношении 12%/47%/41% становится жидкостью уже при минус 78 °C , амальгама ртути и таллия — при минус 61°C. Самым тугоплавким материалом является сплав тантала и карбидов гафния в пропорциях 1:1 с температурой плавления 4115 °C.
Температура плавления металлов
Большая часть элементов периодической таблицы относится к металлам. В настоящее время их насчитывается примерно 96. Всем им необходимы разные условия, чтобы превратиться в жидкость.
Порог нагревания твердых кристаллических веществ, превысив который они становятся жидкими, называется температурой плавления. У металлов она колеблется в пределах нескольких тысяч градусов. Многие из них переходят в жидкость при относительно большом нагревании. Благодаря этому они являются распространенным материалом для производства кастрюль, сковородок и других кухонных приборов.
Средние температуры плавления имеют серебро (962 °С), алюминий (660,32 °С), золото (1064,18 °С), никель (1455 °С), платина (1772 °С) и т.д. Выделяют также группу тугоплавких и легкоплавких металлов. Первым, чтобы превратиться в жидкость, нужно больше 2000 градусов Цельсия, вторым – меньше 500 градусов.
К легкоплавким металлам обычно относят олово (232 °C), цинк (419 °C), свинец (327 °C). Однако у некоторых из них температуры могут быть еще ниже. Например, франций и галлий плавятся уже в руке, а цезий можно греть только в ампуле, ведь от кислорода он воспламеняется.

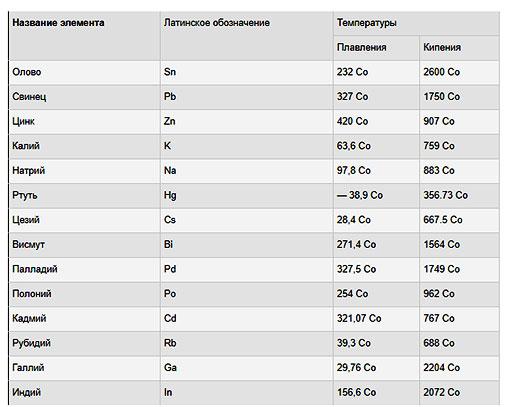
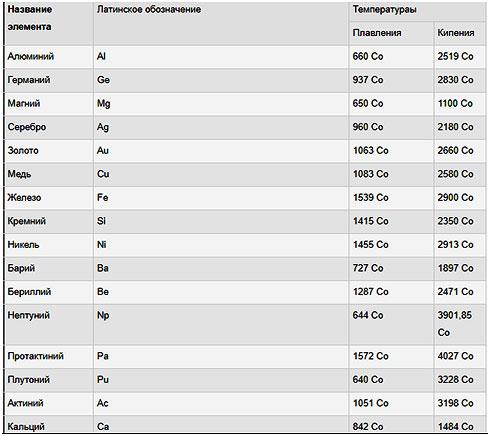
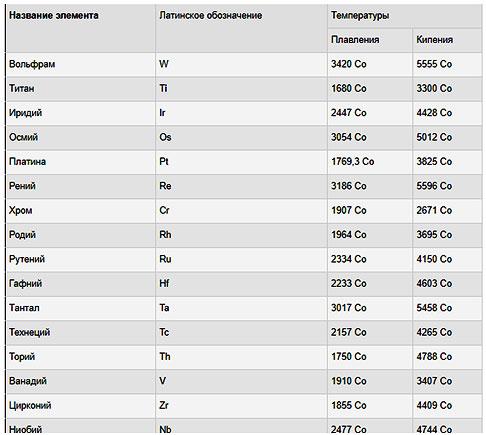
Самые низкие и высокие температуры плавления металлов представлены в таблице:
Применение металлов и их сплавов
Наиболее легкоплавкие металлы
Плавление – процесс перехода из твердого состояния в жидкое. Он происходит под воздействием тепла, но зависит еще от ряда физических факторов, например от давления. Важную роль в том, насколько легко и тяжело вещество поддается плавлению, также играет его состав, размер кристаллов в решетке и прочность связей между атомами.
Температура плавления металлов очень разнится и может иметь даже минусовые значения. Она колеблется от -39 до +3410 градусов Цельсия. Тяжелее всего в жидкость превращаются молибден, вольфрам, хром, титан. Для этого процесса их требуется нагреть до температуры не менее 2000 градусов.
Наиболее легкоплавкими металлами являются галлий, ртуть, литий, олово, свинец, цинк, индий, висмут, таллий. Подробнее о некоторых из них читайте далее.

Использование самого легкоплавкого металла в быту
Несмотря на токсичность, человечество до сих пор не может отказаться от ртути.
Хорошая электропроводимость делает ее незаменимой в энергосберегающих лампах, паровых турбинах, вакуумных и диффузных насосах. Умение реагировать на малейшие колебания температуры и давления используется в барометрах и термометрах.

Батарейки, энергосберегающие лампы, аккумуляторы, контакты выключателей — везде содержится этот высокоионизированный металл. В градуснике находится от 1 до 2 гр этого металла (в стандартных российских 1 гр). Но и эти несколько граммов полностью испарятся из помещения только в течение 20 лет. При концентрации менее 0,25 мгм3 ртуть оседает в легких. При более высоких дозах организм начинает впитывать яд через кожу. Мужчины менее чувствительны к парам, чем дети и женщины.

Вы можете найти ртуть в холодильнике, стиральной машине и кондиционере. Сельское хозяйство чаще всего использует соли ртути в составе пестицидов. Взрывчатка содержит фульминат ртути, антисептики — сульфат.

Фульминат ртути (взрывчатое вещество)
Не могут отказаться от ртути при окрашивании бортов корабля. Морские микроорганизмы всегда селятся там и существенно разрушают обшивку. Только краска на основе «серебряной воды» помогает сохранить судно.

Покраска судна
Человечество с самых древних времен использовало ртуть для добычи из руды драгоценных металлов. Ртуть создает сплавы со всеми металлами (амальгамация) и только благодаря ей добыча серебра и золота в Мексике конкистадорами, начиная XVI века, достигла таких впечатляющих размеров и изменила весь мир.

Добыча золота ртутью
Никогда ртуть не транспортируют в самолетах, причем дело не в токсичности. Ртуть хорошо вступает в контакт со всеми металлами, делая их ломкими. Особенно это касается алюминиевых сплавов — случайная авария может повредить самолет.
Ртуть
Полезный во многих сферах, но ядовитый металл был известен еще до нашей эры. Ртуть использовали античные и средневековые медики для лечения венерических и многих других заболеваний, алхимики пытались сделать из нее золото. Сегодня она применяется в электротехнике, приборостроении и органической химии.
Руть – это наиболее легкоплавкий металл на планете. При нормальных комнатных условиях она всегда жидкая, так как температура ее плавления составляет -39 градуса. Ее пары очень опасны, поэтому ртуть содержат только в контейнерах и специальных стеклянных колбах. На организм она действует как яд, отравляя его и выводя из строя нервную, иммунную, дыхательную и пищеварительную системы.
Галлий
Вторым в списке наиболее легкоплавких металлов находится галлий. Он становится жидкостью при температуре выше 29,5 градусов Цельсия, и размягчить его можно просто подержав немного в руках. При нормальных условиях галлий очень хрупкий, легко поддается механическому воздействию и окрашен в светло-серебристый, несколько голубоватый оттенок.
Металл очень рассеян в земной коре и не встречается в виде самородков. В природе его находят в составе различных минералов, таких как гранат, мусковит, турмалин, хлорит, полевой шпат. Кроме того, он содержится в морской воде. Галлий используют в высокочастотной электронике, для изготовления зеркал и различных сплавов.

Самый токсичный металл
Ртути принадлежит высочайшая степень токсичности. Это самый ядовитый из всех нерадиоактивных элементов на планете, который начинает распространять свои пары при комнатной температуре. Если рядом присутствует человек, происходит поражение пищеварения, легких и нервной системы, причём первые признаки интоксикации наступают очень быстро, через 8 часов.

Симптомы отравления ртутью
И даже воздействие небольших доз, но длительный период, способно проявить себя в виде хронических заболеваний. Нервная система в первую очередь реагирует раздражением, недосыпанием, головными болями и быстрой усталостью. Выводится ртуть через почки. Начинаются частые позывы к мочеиспусканию, повышение температуры, рвота, слабость, тошнота, дрожь в теле.
Самая известная экологическая трагедия XX века, болезнь Минамата, вызвана отравлением метилртутью. Промышленное загрязнение бухты этого японского города в 1956 году привело к 3 тыс. жертв.
Люди всегда знали о токсических свойствах ртути. Например, при изготовлении фетровых шляп использовались ртутные соединения, но другого способа тогда не было. У мастеров часто развивались поражения нервной системы и слабоумие. Поэтому безумный Шляпник, описанный Льюисом Кэрроллом в «Алисе в стране чудес», совсем не выдуманный персонаж.

Безумный Шляпник из «Алисы в стране чудес»
В обычной жизни пищевые отравления грозят любителям морепродуктов. Ртуть содержится и растворяется в морской воде, накапливаясь в организмах его обитателей.
Симптомы хронического отравления часто встречаются в прибрежных районах по всему миру. Особенно страдают беременные и дети, у которых это основная пища. Умеренная олигофрения диагностируется там намного чаще, чем у тех групп, где морская рыба не является основным источником питания.

Хищники, поедая мелочь, сохраняют и приумножает отраву в своих организмах. У каждой четвертой выловленной рыбы содержание металла превышает допустимые пределы. Особенно много его в тунце и лобстере. Экологи бьют тревогу, а компании по производству рыбных продуктов открещиваются. И никакая тепловая обработка не делает мясо менее токсичным.
Индий
В качестве простого вещества индий очень светлый, ковкий и мягкий настолько, что даже оставляет след, если им провести по бумаге. Он также является одним из наиболее легкоплавких металлов, но воздействуют на него только температуры выше 157 °C. Закипает он при 2072 градусах.
Как и галлий, индий не образует собственных месторождений, но содержится в различных рудах. Благодаря своей рассеяности в природе металл довольно дорогой. Его применяют в микроэлектронике, для изготовления легкоплавких сплавов, припоев, жидкокристаллических экранов для техники.

Олово
Олово плавится от температуры выше 231 градуса по Цельсию. Это пластичный и мягкий металл, светло-серебристого цвета. Оно существует четырех аллотропных модификациях, две из них появляются только при высоком давлении.
Олово довольно рассеяно в природе, но может образовывать собственные минералы, например, станнин и касситерит. Его используют в качестве покрытия для металлов для усиления их устойчивости к коррозии, а также для производства жести, фольги, разнообразных сплавов, посуды и деталей для музыкальных инструментов.
Литий
Литий – наиболее легкоплавкий металл, который становится жидкостью при температуре 180 градусов. Он мягкий, хорошо поддается ковке и механической обработке. Он относится к щелочным металлам, но проявляет активность гораздо хуже остальных представителей группы. Он медленно реагирует с влажным воздухом, а в сухой атмосфере остается практически стабильным

Металл встречается в сподумене, лепидолите, в месторождениях с оловом, висмутом и вольфрамом, содержится в морской воде и в звездных космических объектах. Литий часто используется для изготовления гальванических элементов, аккумуляторов, применяют в качестве окислителя, а также в пиротехнике. В сплавах с кадмием, медью и алюминием используется в космической, военной и авиационной технике.



Таблица характеристик
Металлы и сплавы — непременная основа для ковки, литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота, ограды из чугуна, ножи из стали или браслеты из меди), для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Читать также: Флюсы для плавки латуни
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий — 660 °C;
- температура плавления меди — 1083 °C;
- температура плавления золота — 1063 °C;
- серебро — 960 °C;
- олово — 232 °C. Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
- свинец — 327 °C;
- температура плавления железо — 1539 °C;
- температура плавления стали (сплав железа и углерода) — от 1300 °C до 1500 °C. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) — от 1100 °C до 1300 °C;
- ртуть — -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл — ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия — 2519 °C, у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов — у рения — 5596 °C. Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов. Самым лёгким металлом является литий, самым тяжёлым — осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах — это теплопроводность металлов. Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Какова температура плавления металлов — таблицы
Металлы и сплавы — это незаменимая основа для литейного и ювелирного производства, ковки и многих других сфер. Что бы ни делал человек из металла (какой бы это ни был процесс), для правильной работы ему нужно знать, при какой температуре плавится тот или иной металл. Мы подробно рассмотрим процесс плавления, его отличие от кипения, а также сравним температуры в таблицах.
- Таблица температур плавления
- Что такое температура плавления
- При какой температуре плавится
- Плавление железа
- Плавление чугуна
- Плавление стали
- Плавление алюминия и меди
- От чего зависит температура плавления
- У какого металла самая высокая температура плавления
Таблица температур плавления
Узнать какая нужна температура для плавления металлов, поможет таблица по возрастанию температурных показателей.
| Элемент или соединение | Необходимый температурный режим |
|---|---|
| Литий | +18°С |
| Калий | +63,6°С |
| Индий | +156,6°С |
| Олово | +232°С |
| Таллий | +304°С |
| Кадмий | +321°С |
| Свинец | +327°С |
| Цинк | +420°С |
Таблица плавления среднеплавких металлов и сплавов.
| Элемент либо сплав | Температурный режим |
|---|---|
| Магний | +650°С |
| Алюминий | +660°С |
| Барий | +727°С |
| Серебро | +960°С |
| Золото | +1063°С |
| Марганец | +1246°С |
| Медь | +1083°С |
| Никель | +1455°С |
| Кобальт | +1495°С |
| Железо | +1539°С |
| Дюрали | +650°С |
| Латуни | +950…1050°С |
| Чугун | +1100…1300°С |
| Углеродистые стали | +1300…1500°С |
| Нихром | +1400°С |
Таблица плавления тугоплавких металлов и сплавов.
| Наименование элемента | Температурный режим |
|---|---|
| Титан | +1680°С |
| Платина | +1769,3°С |
| Хром | +1907°С |
| Цирконий | +1855°С |
| Ванадий | +1910°С |
| Иридий | +2447°С |
| Молибден | +2623°С |
| Тантал | +3017°С |
| Вольфрам | +3420°С |
Что такое температура плавления
Каждый металл имеет неповторимые свойства, и в этот список входит температура плавления. При плавке металл уходит из одного состояния в другое, а именно из твёрдого превращается в жидкое. Чтобы сплавить металл, нужно приблизить к нему тепло и нагреть до необходимой температуры – этот процесс и называется температурой плавления. В момент, когда температура доходит до нужной отметки, он ещё может пребывать в твёрдом состоянии. Если продолжать воздействие – металл или сплав начнет плавиться.
Плавление и кипение – это не одно и то же. Точкой перехода вещества из твердого состояния в жидкое, зачастую называют температуру плавления металла. В расплавленном состоянии у молекул нет определенного расположения, но притяжение сдерживает их рядом, в жидком виде кристаллическое тело оставляет объем, но форма теряется.
При кипении объем теряется, молекулы между собой очень слабо взаимодействуют, движутся хаотично в разных направлениях, совершают отрыв от поверхности. Температура кипения – это процесс, при котором давление металлического пара приравнивается к давлению внешней среды.
Для того, чтобы упростить разницу между критическими точками нагрева мы подготовили для вас простую таблицу:
| Свойство | Температура плавки | Температура кипения |
|---|---|---|
| Физическое состояние | Сплав переходит в расплав, разрушается кристаллическая структура, проходит зернистость | Переходит в состояние газа, некоторые молекулы могут улетать за пределы расплава |
| Фазовый переход | Равновесие между твердым состоянием и жидким | Равновесие давления между парами металла и воздухом |
| Влияние внешнего давления | Нет изменений | Изменения есть, температура уменьшается при разряжении |
При какой температуре плавится
Металлические элементы, какими бы они ни были — плавятся почти один в один. Этот процесс происходит при нагреве. Оно может быть, как внешнее, так и внутреннее. Первое проходит в печи, а для второго используют резистивный нагрев, пропуская электричество либо индукционный нагрев. Воздействие выходит практически схожее. При нагреве, увеличивается амплитуда колебаний молекул. Образуются структурные дефекты решётки, которые сопровождаются обрывом межатомных связей. Под процессом разрушения решётки и скоплением подобных дефектов и подразумевается плавление.
У разных веществ разные температуры плавления. Теоретически, металлы делят на:
- Легкоплавкие – достаточно температуры до 600 градусов Цельсия, для получения жидкого вещества.
- Среднеплавкие – необходима температура от 600 до 1600 ⁰С.
- Тугоплавкие – это металлы, для плавления которых требуется температура выше 1600 ⁰С.
Плавление железа
Температура плавления железа достаточно высока. Для технически чистого элемента требуется температура +1539 °C. В этом веществе имеется примесь — сера, а извлечь ее допустимо лишь в жидком виде.
Без примесей чистый материал можно получить при электролизе солей металла.
Плавление чугуна
Чугун – это лучший металл для плавки. Высокий показатель жидкотекучести и низкий показатель усадки дают возможность эффективнее пользоваться им при литье. Далее рассмотрим показатели температуры кипения чугуна в градусах Цельсия:
- Серый — температурный режим может достигать отметки 1260 градусов. При заливке в формы температура может подниматься до 1400.
- Белый — температура достигает отметки 1350 градусов. В формы заливается при показателе 1450.
Плавление стали
Сталь — это сплав железа с примесью углерода. Её главная польза — прочность, поскольку это вещество способно на протяжении длительного времени сохранять свой объем и форму. Связано это с тем, что частицы находятся в положении равновесия. Таким образом силы притяжения и отталкивания между частицами равны.
Плавление алюминия и меди
Температура плавления алюминия равна 660 градусам, это означает то, что расплавить его можно в домашних условиях.
Чистой меди – 1083 градусов, а для медных сплавов составляет от 930 до 1140 градусов.
От чего зависит температура плавления
Для разных веществ температура, при которой полностью перестраивается структура до жидкого состояния – разная. Если взять во внимание металлы и сплавы, то стоит подметить такие моменты:
- В чистом виде не часто можно встретить металлы. Температура напрямую зависит от его состава. В качестве примера укажем олово, к которому могут добавлять другие вещества (например, серебро). Примеси позволяют делать материал более либо менее устойчивым к нагреву.
- Бывают сплавы, которые благодаря своему химическому составу могут переходить в жидкое состояние при температуре свыше ста пятидесяти градусов. Также бывают сплавы, которые могут «держаться» при нагреве до трех тысяч градусов и выше. С учетом того, что при изменении кристаллической решетки меняются физические и механические качества, а условия эксплуатации могут определяться температурой нагрева. Стоит отметить, что точка плавления металла — важное свойство вещества. Пример этому – авиационное оборудование.
Термообработка, в большинстве случаев, почти не изменяет устойчивость к нагреву. Единственно верным способом увеличения устойчивости к нагреванию можно назвать внесение изменений в химический состав, для этого и проводят легирование стали.
У какого металла самая высокая температура плавления
Твердый, тугоплавкий, достаточно тяжелый материал светло-серого цвета, который имеет металлический блеск. Механической обработке поддается с трудом. При комнатной температуре достаточно хрупок и ломается. Ломкость металла связана с загрязнением примесями углерода и кислорода.
Примечание! Технически, чистый металл при температуре выше четырехсот градусов по Цельсию становится очень пластичным. Демонстрирует химическую инертность, неохотно вступает в реакции с другими элементами. В природе встречается в виде таких сложных минералов, как: гюбнерит, шеелит, ферберит и вольфрамит.
Вольфрам можно получить из руды, благодаря сложным химическим переработкам, в качестве порошка. Используя прессование и спекание, из него создают детали обычной формы и бруски.
Вольфрам — крайне стойкий элемент к любым температурным воздействиям. По этой причине размягчить вольфрам не могли более сотни лет. Не существовало такой печи, которая смогла бы нагреться до нескольких тысяч градусов по Цельсию. Ученым удалось доказать, что это самый тугоплавкий металл. Хотя бытует мнение, что сиборгий, по некоторым теоретическим данным, имеет большую тугоплавкость, но это лишь предположение, поскольку он является радиоактивным элементом и у него небольшой срок существования.
Легкоплавкие металлы – список, особенности и значение для человека
Однозначности в классификации этой группы металлов у специалистов нет. Их главное свойство содержится в названии – легкоплавкие металлы.

- Что представляет собой
- Перечень
- Классификация
- Где и как применяются
- Особенности использования
- Области применения
- Биологическое воздействие
Что представляет собой
Как понятно из названия, легкоплавким считается металл с малой температурой плавления.
В номенклатуре, принятой Международным союзом теоретической и прикладной химии (ИЮПАК), термин «легкоплавкие металлы» отсутствует.
У специалистов единства тоже нет. Одни выставляют «порог плавления» в 500°С. Для других легкоплавким металлом является металл, расплавляющийся при менее 600°С.
Перечень
В соответствии с основной классификацией (температура плавления не более 500°С), к списку легкоплавов причислены следующие элементы:
| Название | Температура плавления (°С) |
| Цинк | 419 |
| Палладий | 327 |
| Свинец | 327 |
| Кадмий | 321 |
| Таллий | 303 |
| Висмут | 271 |
| Полоний | 254 |
| Олово | 232 |
| Индий | 157 |
| Натрий | 98 |
| Калий | 63 |
| Рубидий | 39 |
| Галлий | 30 |
| Цезий | 28 |
| Ртуть | – 39 |
Ртуть – самый легкоплавкий металл. Она единственная из группы плавится на морозе.
Галлий называют металлом, тающим в руках (нормальная температура тела человека выше точки плавления вещества почти на семь градусов).
Классификация
Легкоплавы подразделяются на две группы:
- Тяжелые легкоплавкие металлы – кадмий, кобальт, свинец, ртуть.
- Легкие легкоплавкие металлы – кадмий, олово, галлий, индий, таллий, полоний, висмут.
К драгоценным элементам причислен палладий.
 Палладий
Палладий
Легкие элементы полоний и висмут радиоактивны .
 Висмут
Висмут
Олово, таллий, свинец, цезий – мягкие легкоплавы.
 Свинец
Свинец
Самый мягкий легкоплавкий металл – цезий (0,2 по шкале твердости Мооса).
Где и как применяются
Для всех сфер применения решающее преимущество данной группы – низкая температура плавления.
Особенности использования
На основании этого свойства легкоплавких металлов определены способы использования:
- Мягкие легкоплавы – материал пайки микросхем. Пайка обычным припоем исключена, поскольку создает перегрев, который их расплавит.
- Гораздо чаще используются сплавы. Они легкоплавки, но плотные, прочные на разрыв, химически инертны.
- Самые востребованные соединения: свинцовые, оловянные, кадмиевые, цинковые, ртутные. А также с висмутом, таллием, индием, галлием как базисным компонентом.
Легкоплавкие сплавы – это конгломерат металлов с температурой плавления не выше «оловянной» (232°С). Нижний предел – минус 61°C. На таком холоде плавится амальгама таллия.
Области применения
Сферы применения материала: энергетика, машиностроение, электро-, радиотехника, химпром:
- Основа жидких теплоносителей, смазка.
- Выплавка моделей сложной конфигурации.
- Пожарный сегмент: термодатчики, клапаны тушения огня, другая аппаратура раннего оповещения о возгораниях.
- Основа термометров разных видов и предназначения.
- Верхний слой, предохранители, термодатчики микроэлектроники.
- Медицина. Материал протезов, фиксатор при переломах.
Это также проводники, антикоррозионные покрытия, компонент антифрикционных сплавов.
Используются уникальные свойства отдельных позиций из списка легкоплавов:
- Свинец – материал подшипников, предохранителей, аккумуляторов, оболочка кабеля. Это щит от радиоактивного излучения.
- Олово – защитный слой стали.
- Цинк – компонент латуней, анодное покрытие стальных изделий с высоким КПД.
- Галлий – заменитель ртути, сохраняющий вакуум в аппаратуре.
Легко плавящиеся сплавы образуют также щелочные металлы. На практике такие материалы используются мало из-за чрезмерной химической активности.
Биологическое воздействие
Влияние легкоплавов на организм человека различно:
- Без калия как удобрения растения чахнут, плохо плодоносят. В организме человека работает в дуэте с натрием. Под его контролем жизненно важные процессы.
- Микродозы кадмия содействуют метаболизму. Однако вещество, его растворимые соединения токсичны.
- Висмут токсичен, но безопасен для биологических организмов. Это радиоактивное вещество, поэтому аптечные препараты с ним нужно применять строго по инструкции.
- О токсичности галлия точки зрения противоположны – от малой до высокой степени. Но интоксикация веществом реальна.
- Бесполезные для человека как биологического объекта свинец и ртуть токсичны. Особенно опасна ртуть из разбившегося домашнего градусника.
На особом счету таллий. Мягкое серебристое с сероватой голубизной вещество – сильнейший яд. Его «вывела в свет» как средство получения наследства, решения других проблем Агата Кристи. Описание яда, технологии его применения содержит десяток романов королевы английского детектива.
Самый тугоплавкий металл
Что такое тугоплавкость металлов?
Суть термина должна быть ясна из самого словосочетания – это металлы, которые «туго» /тяжело плавятся. В большинстве научной и технической литературы, термин присваивается на основании минимальной температуры плавления химического элемента – от +2 200 градусов по Цельсию.

Дополнительные химические элементы относятся к так называемой расширенной группе тугоплавких металлов – 9 веществ + 5 из основной группы. Существуют и другие металлы, у которых температура плавления входит в промежуток тугоплавких веществ, но они расположены в периодической системе за ураном (трансурановые).
В силу нестабильности изотопов + малого распространения по земной поверхности, трансурановые металлы не относят к группе тугоплавких.
Физические/химические свойства тугоплавких металлов:
- если не брать в расчет углерод с осмием, температурные показатели для плавления у веществ не имеет конкурентов в таблице Менделеева;
- высокий порог сопротивления к деформации вещества под постоянным воздействием давления механического типа (деформация ползучести). У обычных металлических элементов оговоренный порог начинается от 220 градусов, а у тугоплавких от 15000 градусов. Именно потому ковать железо куда проще, нежели изделие с ниобия или другого тугоплавкого вещества;
- благодаря простоте вступления в реакции соединения с прочими химическими элементами, найти тугоплавкие металлы в чистом виде почти нереально;
- на открытом воздухе тугоплавкие металлы окисляются очень медленно. Почти сразу на поверхности образовывается защитный слой в виде пленки;
- при нагревании неплавких металлов, те становятся уязвимыми к коррозии. Повышается их хрупкость + теряется 50%+ свойств.
Физические свойства тугоплавких металлов сильно отличаются из-за их принадлежности к различным группам. Все 100% элементов – тугоплавкие, но только 25% из них можно отнести к жаростойким. Подобное различие обусловлено сменой физических свойств при нагревании химического элемента. Металл может стать подвержен действиям агрессивных сред, таких как щелочи и кислоты. Детальнее по каждому из тугоплавких металлов будет ниже.
Характеристики самого плотного металла
Ученые сошлись во мнении, что, несмотря на практически одинаковую плотность, иридий совсем чуть-чуть уступает самому тяжелому металлу. Однако полностью физико-химические свойства этих двух элементов пока не изучены.
Редкостью и трудозатратностью добычи обусловлена стоимость осмия – в среднем от $15 000 за грамм. Он внесен в группу платиновых и условно считается благородным, однако название металла противоречит статусу: по-гречески «осме» значит «запах». Из-за высокой химической активности осмий пахнет смесью чеснока или редьки с хлором.
Застывая из расплава, осмий образует красивые кристаллы с интересным сине- или серебристо-голубым отливом. Но, несмотря на красоту, для изготовления драгоценных аксессуаров он не подходит, так как не обладает свойствами, необходимыми ювелирам: ковкостью и пластичностью.
Элемент ценен только из-за особой прочности. Сплавы, в которые добавляют совсем малые дозы самого тяжелого металла, становятся невероятно износостойкими. Обычно им покрывают узлы, подвергающиеся постоянному трению.
История открытия
1803—1804 годы стали для самого тяжелого металла поворотными: именно в это время его открытие проходило практически в условиях соревнований.
Сначала английский химик Смитсон Теннант и его ассистент Уильям Хайд Уолластон, совершившие не одно важное открытие, обнаружили в процессе эксперимента с платиновыми рудами и азотной и соляной кислотами необычный осадок с характерным запахом и поделились своей находкой с другими. Далее эстафету перехватили французские ученые Антуан де Фуркруа и Луи-Николя Воклен и на основе предыдущих и своих собственных исследований заявили об обнаружении нового элемента
Название ему дали «птен», что значит «летучий», так как в результате опытов они получали летучий черный дым
Далее эстафету перехватили французские ученые Антуан де Фуркруа и Луи-Николя Воклен и на основе предыдущих и своих собственных исследований заявили об обнаружении нового элемента. Название ему дали «птен», что значит «летучий», так как в результате опытов они получали летучий черный дым.

Однако и Теннант не спал: он продолжал свои исследования и не упускал из виду опыты французов. В итоге Смитсон добился более конкретных результатов и в официальном документе, отправленном Лондонскому королевскому обществу, указал, что разделил птен на два родственных элемента: иридий («радуга») и осмий («запах»).
Где применяют
Список сфер применения довольно обширен: авиация, военная и ракетная техника, аэрокосмическая промышленность, медицина. Хотя производители оружия уже задумываются, чем можно заменить самый тяжелый в мире металл, так как осмий слишком трудно обрабатывать.










Почти половина мировых запасов самого тяжелого металла отдана на нужды химической промышленности. Им окрашивают живые ткани под микроскопом, обеспечивая их сохранность. Кроме того, его применяют как краситель при росписи фарфора.
Изотопы самого тяжелого металла используют для изготовления тары для хранения ядерных отходов.
Места природного залегания
В чистом виде осмий обнаружить практически нереально. Обычно этот тяжелый элемент встречается в соединении с иридием. Вещество содержится в месторождениях платиновых руд и на месте падения или в самих попавших на Землю метеоритах.
Вольфрам – самый тугоплавкий металл
Это твердый и тяжелый материал с металлическим блеском, светло-серого цвета, обладающий высокой тугоплавкостью. Механической обработке поддается трудно. При комнатной температуре он является хрупким металлом и легко ломается. Вызвано это загрязнением его примесями кислорода и углерода. Технически чистый вольфрам при температуре более 400 градусов Цельсия становится пластичным. Проявляет химическую инертность, плохо вступает в реакции с другими элементами. В природе вольфрам встречается в виде сложных минералов, таких как:
- шеелит;
- вольфрамит;
- ферберит;
- гюбнерит.

Вольфрам получают из руды, применяя сложные химические переработки, в виде порошка. Используя методы прессования и спекания, изготовляют детали простой формы и бруски. Вольфрам — очень стойкий элемент к температурным воздействиям. Поэтому размягчить металл не могли в течение ста лет. Не имелось таких печей, которые могли бы разогреваться до нескольких тысяч градусов. Ученые доказали, что самым тугоплавким металлом является вольфрам. Хотя существует мнение, что сиборгий, по теоретическим данным, обладает большей тугоплавкостью, но утверждать твердо этого нельзя, так как он радиоактивный элемент и имеет маленький срок существования.
Температура плавления металлов
Большая часть элементов периодической таблицы относится к металлам. В настоящее время их насчитывается примерно 96. Всем им необходимы разные условия, чтобы превратиться в жидкость.
Порог нагревания твердых кристаллических веществ, превысив который они становятся жидкими, называется температурой плавления. У металлов она колеблется в пределах нескольких тысяч градусов. Многие из них переходят в жидкость при относительно большом нагревании. Благодаря этому они являются распространенным материалом для производства кастрюль, сковородок и других кухонных приборов.
Средние температуры плавления имеют серебро (962 °С), алюминий (660,32 °С), золото (1064,18 °С), никель (1455 °С), платина (1772 °С) и т.д. Выделяют также группу тугоплавких и легкоплавких металлов. Первым, чтобы превратиться в жидкость, нужно больше 2000 градусов Цельсия, вторым – меньше 500 градусов.
К легкоплавким металлам обычно относят олово (232 °C), цинк (419 °C), свинец (327 °C). Однако у некоторых из них температуры могут быть еще ниже. Например, франций и галлий плавятся уже в руке, а цезий можно греть только в ампуле, ведь от кислорода он воспламеняется.

Самые низкие и высокие температуры плавления металлов представлены в таблице: