Виды кристаллических решеток металлов
Виды кристаллических решеток металлов
Кристаллические решетки металлов и их основные типы
Металлы и сплавы имеют кристаллическое строение. Это означает, что атомы в занимаемом ими пространстве расположены строго упорядоченно, находясь в определенных местах на вполне определенных расстояниях друг от друга. В пределах одного кристалла наблюдается повторяющаяся картина расположения атомов. Если соединить атомы воображаемыми линиями в трех взаимно перпендикулярных направлениях, то получится пространственная
кристаллическая решетка. Ее наименьшим структурным образованием является элементарная ячейка, контур которой представляет какое-нибудь составленное из атомов геометрическое тело, например куб или шестигранную призму. Элементарные ячейки, примыкая друг к другу и многократно повторяясь, образуют более крупные твердые тела правильной геометрической формы — кристаллы. Кристаллы, формирующиеся в процессе роста под воздействием окружающих кристаллов и имеющие поэтому неправильную геометрическую форму, называют кристаллитами. Кристаллиты в поликристаллическом теле, отделенные от других кристаллитов большеугловыми границами (см. подпараграф 1.5.3) и обладающие определенной кристаллографической ориентировкой, называют зернами.
Ориентировка ячеек в соседних зернах различна, а в пределах каждого зерна одинакова. Поэтому в кристаллической решетке зерен существует ближний и дальний порядки. Ближний порядок означает постоянство ближних атомов-соседей у каждого атома, а дальний — удаленных.
Наиболее простой геометрической формой кристаллической решетки металлов является кубическая. Эта форма решетки имеет две разновидности: объемно-центрированную кубическую (ОЦК) и гранецентрированную кубическую (ГЦК). На рис. 1.3, а, б показаны схемы этих решеток. У обоих типов рассматриваемых решеток основу ячеек составляют восемь атомов, образующих куб и находящихся в его вершинах. Остальные атомы находятся или в центре куба (один атом на пересечении диагоналей в решетке ОЦК), или в центре каждой из его граней (шесть атомов в решетке ГЦК).
Кристаллические ОЦК-решетки в числе прочих металлов имеют хром, ванадий, молибден. А ГЦК-рсшстки имеют алюминий, медь, никель и другие металлы. Характерными признаками кристаллической решетки являются параметр решетки, координационное число и плотность упаковки атомов. Параметром (или периодом) кристаллической решетки а считают межатомное расстояние в ячейке (см. рис. 1.3). Координационное число (к.ч.) определяет

Рис. 1.3. Основные тины кристаллических решеток
число ближайших соседей каждого атома. А под плотностью упаковки (п.у.) понимают число атомов, приходящихся на одну элементарную ячейку. Для решетки ОЦК п.у. = 2 (один атом в вершине куба, а второй в центре куба), к.ч. = 8 (например, для атома, расположенного в центре куба). Для решетки ГЦК п.у. = 4, к.ч. = 12. Параметр решетки а для ОЦК-решеток и ГЦК-решеток одинаков по всем трем направлениям в пространстве.
Таким образом, ГЦК-решетка является более плотной, чем ОЦК-решетка. От плотности упаковки кристаллической решетки зависит прочность металлов.
Однако наиболее плотной из рассматриваемых кристаллических решеток является гексагональная плотноупакованнаярешетка (ГПУ). Схема этой решетки представлена на рис. 1.3, в. Ячейка этой решетки представляет собой шестигранную призму с центрированными основаниями, между которыми на некотором расстоянии от центров трех граней расположены еще три атома. Характеристики решетки ГПУ: параметры решетки а и с (с > а); если с/а = 1,633, то к.ч. = 12, п.у. = 6. Решетку ГПУ имеют магний, цинк, бериллий и другие металлы.
Параметры кристаллических решеток металлов составляют от 0,2 до 0,7 нм (1 нм = 1(Г 9 м).
В ячейках кристаллических решеток атомы касаются друг друга внешними слоями электронных оболочек. Межатомные силы сцепления, обеспечивающие целостность кристаллической решетки, создаются электромагнитным взаимодействием, обусловленным наличием у атомов валентных электронов. У металлов, находящихся в твердом состоянии, валентные электроны, освобождаясь от своих атомов, движутся между атомами, которые становятся положительно заряженными ионами. Это объясняется тем, что внешние электроны металлов, в отличие от внешних электронов неметаллов, слабо связаны с ядром. Поэтому атомы металлов легко теряют внешние электроны, превращаясь в ионы. Освободившиеся электроны образуют так называемый электронный газ. Принадлежащие всему зерну свободные электроны, взаимодействуя с положительными ионами, обеспечивают целостность кристаллической решетки. Такая межатомная связь в кристаллической решетке получила название металлической. Металлическая связь может существовать как между одноименными атомами в чистых металлах, так и между разнородными — в сплавах. Металлическая межатомная связь не имеет направленного характера. Электроны электронного газа не связаны с отдельными ионами, а в одинаковой степени принадлежат всем ионам металла.
Благодаря наличию электронного газа металлы обладают высокими электро- и теплопроводностью, а также металлическим блеском. Под действием электрического поля свободные электроны
приобретают направленное движение, обеспечивающее протекание тока. Высокая теплопроводность металла обусловлена также участием свободных электронов (наряду с ионами) в передаче тепла. А характерный металлический блеск металлов обусловлен взаимодействием свободных электронов с электромагнитными световыми волнами.
Типы кристаллических решеток металлов
Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ). Такой тип структуры называется металлической связью.
Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела.
Металлы имеют относительно сложные типы кубических решеток — объемно центрированная (ОЦК) и гранецентрированная (ГЦК) кубические решетки.
Кубическая (1 атом на ячейку), а)
Объемно-центрированная кубическая (ОЦК) (2 атома на ячейку), б)
Гранецентрированная кубическая (ГЦК) (4 атома на ячейку), в)
Гексагональная плотноупакованная (ГП) (6 атомов на ячейку), г)
Рис. 2. Основные типы кристаллических решеток металлов
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис. 2, б), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
У ГЦК-решетки (рис. 2, в) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис. 2, г). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
У гексагональных решеток отношение параметра с/а всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, берилий, титан и др.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметр решетки — это расстояние между атомами по ребру элементарной ячейки. Параметры решетки измеряется в нанометрах (1 нм = 10 -9 м =10 A). Параметры кубических решеток характеризуются длиной ребра куба и обозначаются буквой а.
Для характеристики гексагональной решетки принимают два параметра — сторону шестигранника а и высоту призмы с. Когда отношение с/а =1,633, то атомы упакованы наиболее плотно, и решетка называется гексагональной плотноупакованной (рис. 1, г). Некоторые металлы имеют гексагональную решетку с менее плотной упаковкой атомов (с/а > 1,633). Например, для цинка с/а = 1,86, для кадмия с/а = 1,88.
Параметры а кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой а лежит в пределах 0,228-0,398 нм, а с в пределах 0,357-0,652 нм.
Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Например, для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум. И лишь атом, находящийся в центре куба, полностью принадлежит данной ячейке.

Рис. 3. Координационное число в различных кристаллических решетках для атома А: а) — объемноцентрированная кубическая (К 8); б) — гранецентрированная кубическая (К 12); в) — гексагональная плотноупакованная (Г 12)
Таким образом, ОЦК- и ГЦК-ячейки содержат соответственно 2 и 4 атома.
Под координационным числом понимается количество ближайших соседей данного атома.
В ОЦК решетке (рис. 3, а) атом А (в центре) находится на наиболее близком равном расстоянии от восьми атомов, расположенных в вершинах куба, т. е. координационное число этой решетки равно 8 (К 8).
В ГЦК решетке (рис. 3, б) атом А (на грани куба) находится на наиболее близком равном расстоянии от четырех атомов 1, 2, 3, 4, расположенных в вершинах куба, от четырех атомов 5, 6, 7, 8, расположенных на гранях куба, и, кроме того, от четырех атомов 9, 10, 11, 12, принадлежащих расположенной рядом кристаллической ячейке. Атомы 9, 10, 11, 12 симметричны атомам 5, 6, 7, 8. Таким образом, ГЦК решетки координационное число равно 12 (К 12).
В ГПУ решетке при с/а = 1,633 (рис. 3, в) атом А в центре шестигранного основания призмы находится на наиболее близком равном расстоянии от шести атомов 1, 2, 3, 4, 5, 6, размещенных в вершинах шестигранника, и от трех атомов 7, 8, 9, расположенных в средней плоскости призмы. Кроме того, атом А оказывается на таком же расстоянии еще от трех атомов 10, 11, 12, принадлежащих кристаллической ячейке, лежащей ниже основания. Атомы 10, 11, 12 симметричны атомам 7, 8, 9.
Следовательно, для ГПУ решетки координационное число равно 12 (Г 12).
Плотность упаковки представляет собой отношение суммарного объема, занимаемого собственно атомами в кристаллической решетке, к ее полному объему. Различные типы кристаллических решеток имеют разную плотность упаковки атомов. В ГЦК решетке атомы занимают 74 % всего объема кристаллической решетки, а межатомные промежутки («поры») 26 %. В ОЦК решетке атомы занимают 68 % всего объема, а «поры» 32 %. Компактность решетки зависит от особенностей электронной структуры металлов и характера связи между их атомами.
От типа кристаллической решетки сильно зависят свойства металла.
У некоторых металлов кристаллическая решетка может изменяться при изменении температуры. Это явление называется полиморфизмом или аллотропией. Полиморфизм может вызывать изменение свойств.
Кристаллическое строение металлов. Характерные свойства металлов. Виды кристаллических решеток, дефекты их строения
Металлы – простые вещества, обладающие в обычных условиях характерными свойствами:
· специфический «металлический» блеск (хорошая отражательная способность и непрозрачность);
· отрицательный температурный коэффициент электропроводности (возрастание электросопротивления с повышением температуры).
Самыми распространенными в природе металлами являются алюминий, железо, кальций, натрий, калий, магний и титан.
Характерные свойства металлов обусловлены строением их атомов.
Из курса физики известно, что атом состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных частичек — электронов. В ядре атома находятся положительно заряженные частицы — протоны. Количество протонов равно количеству окружающих ядро электронов, т. е. атом в целом является электрически нейтральным.
Атом может терять или приобретать электроны. Тогда он превращается в электрически заряженный атом — ион. При избытке электронов ион заряжен отрицательно, при недостатке электронов — положительно.
Принадлежащие атому электроны разделяют на валентные (внешние), движущиеся по внешним орбитам, и внутренние, движущиеся по более близким к ядру орбитам.
Благодаря слабой связи внешних электронов с ядром в металлах всегда имеются электроны, подвергающиеся воздействию положительно заряженных ядер близлежащих атомов. Такие электроны называются свободными. Свободные электроны принадлежат не одному какому-либо ядру, а блуждают по всему металлу, вращаясь вокруг ядра то одного, то другого иона.
Наличием большого количества свободных электронов (называемых также коллективными или «электронный газ») и объясняются указанные выше характерные признаки металлов.
В отличие от металлов неметаллы, как правило, хрупки, лишены металлического блеска, имеют низкую тепло- и электропроводность. Электросопротивление неметаллов с повышением температуры понижается.
Все металлы в нормальных условиях являются твёрдыми телами (за исключением ртути) и представляют собой вещества, состоящие из большого числа мелких зёрен – кристаллов, упорядоченно расположенных друг относительно друга в пространстве. Этот порядок определяется понятием кристаллическая решётка.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Основными типами кристаллических решёток являются:
1) Объемно — центрированная кубическая (ОЦК) (см. рис.1 а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, Feα)
2) Гранецентрированная кубическая (ГЦК) (см. рис. 1 б), атомы располагаются в вершинах куба и по центру каждой из 6 граней (Cu, Al, Ag, Au, Feγ)
3) Гексагональная, в основании которой лежит шестиугольник:
простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
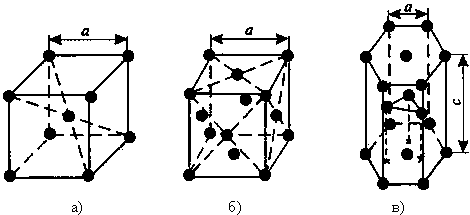
Рисунок 1 — Основные типы кристаллических решеток: а – объемно-центрированная кубическая;
б– гранецентрированная кубическая; в – гексагональная плотноупакованная
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропиейилиполиморфизмом.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe): t 1539°С – ОЦК — Feσ.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
В кристаллической решетке реальных металлов имеются различные дефекты (несовершенства), которые нарушают связи между атомами и оказывают влияние на свойства металлов. Различают точечные, линейные и поверхностные дефекты.
Одним из распространенных несовершенств кристаллического строения является наличие точечных дефектов: вакансий, дислоцированных атомов и примесей (рис. 2).
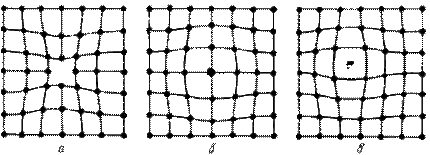
Рисунок 2 — Точечные дефекты
Вакансия – отсутствие атомов в узлах кристаллической решетки.
Дислоцированный атом – это атом, вышедший из узла решетки и занявший место в междоузлие.
Примесные атомы всегда присутствуют в металле, так как практически невозможно выплавить химически чистый металл. Они могут иметь размеры больше или меньше размеров основных атомов и располагаются в узлах решетки или междоузлиях.
Точечные дефекты вызывают незначительные искажения решетки, что может привести к изменению свойств тела (электропроводность, магнитные свойства), их наличие способствует процессам диффузии и протеканию фазовых превращений в твердом состоянии. При перемещении по материалу дефекты могут взаимодействовать.
Основными линейными дефектами являются дислокации.
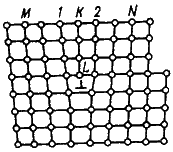 Дислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Простейшие виды дислокаций – краевые и винтовые.
Дислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Простейшие виды дислокаций – краевые и винтовые.
Рисунок 3 — Искажения в кристаллической решетке при наличии краевой дислокации
Плотность дислокации в значительной мере определяет пластичность и прочность материала. С увеличением плотности дислокаций возрастает внутреннее механическое напряжение, изменяются оптические свойства, повышается электросопротивление металла. Дислокации ускоряют старение и другие процессы, уменьшают химическую стойкость, поэтому в результате обработки поверхности кристалла специальными веществами в местах выхода дислокаций образуются ямки.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
1.Металлы. Строение и свойства металлов. Металлическая связь. Типы кристаллических решёток металлов. Полиморфизм и анизотропия.
Объемно-центрированная кубическая (ОЦК) (2 атома на ячейку), б)
Гранецентрированная кубическая (ГЦК) (4 атома на ячейку), в)
Гексагональная плотноупакованная (ГП) (6 атомов на ячейку), г)
Рис. 2. Основные типы кристаллических решеток металлов
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис. 2, б), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
У ГЦК-решетки (рис. 2, в) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис. 2, г). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
У гексагональных решеток отношение параметра с/а всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, берилий, титан и др.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметр решетки – это расстояние между атомами по ребру элементарной ячейки. Параметры решетки измеряется в нанометрах (1 нм = 10 -9 м =10 A). Параметры кубических решеток характеризуются длиной ребра куба и обозначаются буквой а.
Для характеристики гексагональной решетки принимают два параметра – сторону шестигранника а и высоту призмы с. Когда отношение с/а =1,633, то атомы упакованы наиболее плотно, и решетка называется гексагональной плотноупакованной (рис. 1, г). Некоторые металлы имеют гексагональную решетку с менее плотной упаковкой атомов (с/а > 1,633). Например, для цинка с/а = 1,86, для кадмия с/а = 1,88.
Параметры а кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой а лежит в пределах 0,228-0,398 нм, а с в пределах 0,357-0,652 нм.
Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Например, для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум. И лишь атом, находящийся в центре куба, полностью принадлежит данной ячейке.

Рис. 3. Координационное число в различных кристаллических решетках для атома А: а) – объемноцентрированная кубическая (К 8); б) – гранецентрированная кубическая (К 12); в) – гексагональная плотноупакованная (Г 12)
Таким образом, ОЦК- и ГЦК-ячейки содержат соответственно 2 и 4 атома.
Под координационным числом понимается количество ближайших соседей данного атома.
В ОЦК решетке (рис. 3, а
) атом
А
(в центре) находится на наиболее близком равном расстоянии от восьми атомов, расположенных в вершинах куба, т. е. координационное число этой решетки равно 8 (К 8).
В ГЦК решетке (рис. 3, б)
атом
А
(на грани куба) находится на наиболее близком равном расстоянии от четырех атомов
1
,
2, 3, 4,
расположенных в вершинах куба, от четырех атомов
5, 6, 7, 8,
расположенных на гранях куба, и, кроме того, от четырех атомов
9, 10, 11, 12,
принадлежащих расположенной рядом кристаллической ячейке. Атомы
9, 10, 11, 12
симметричны атомам
5
,
6, 7, 8.
Таким образом, ГЦК решетки координационное число равно 12 (К 12).
В ГПУ решетке при с/а =
1,633 (рис. 3,
в
) атом
А
в центре шестигранного основания призмы находится на наиболее близком равном расстоянии от шести атомов
1
,
2, 3, 4, 5, 6,
размещенных в вершинах шестигранника, и от трех атомов
7, 8, 9,
расположенных в средней плоскости призмы. Кроме того, атом
А
оказывается на таком же расстоянии еще от трех атомов
10, 11, 12,
принадлежащих кристаллической ячейке, лежащей ниже основания. Атомы
10, 11, 12
симметричны атомам
7, 8, 9.
Следовательно, для ГПУ решетки координационное число равно 12 (Г 12).
Плотность упаковки представляет собой отношение суммарного объема, занимаемого собственно атомами в кристаллической решетке, к ее полному объему. Различные типы кристаллических решеток имеют разную плотность упаковки атомов. В ГЦК решетке атомы занимают 74 % всего объема кристаллической решетки, а межатомные промежутки (“поры”) 26 %. В ОЦК решетке атомы занимают 68 % всего объема, а “поры” 32 %. Компактность решетки зависит от особенностей электронной структуры металлов и характера связи между их атомами.
От типа кристаллической решетки сильно зависят свойства металла.
У некоторых металлов кристаллическая решетка может изменяться при изменении температуры. Это явление называется полиморфизмом
или
аллотропией
. Полиморфизм может вызывать изменение свойств.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Виды кристаллических решеток металлов
Взаимосвязь типа химической связи с видом кристаллической решетки
Вещества и кристаллические решетки
Твердые вещества бывают аморфные или кристаллические (чаще всего имеют кристаллическое строение).
Кристаллическое строение характеризуется правильным расположением частиц в определенных точках пространства. При соединении этих точек воображаемыми прямыми линиями образуется так называемая кристаллическая решетка. Точки, в которых размещены частицы, называются узлами кристаллической решетки.
В узлах кристаллической решетки могут находиться ионы, атомы или молекулы.
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток:

Ионная решетка

Эту решетку образуют все вещества с ионным типом связи — соли, щелочи, бинарные соединения активных металлов с активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты, соли аммония и аминов. В узлах решетки — ионы, между которыми существует электростатическое притяжение. Ионная связь очень прочная.
Свойства ионных кристаллов :
· твердые, но хрупкие;
· отличаются высокими температурами плавления;
· нелетучи, не имеют запаха;
· расплавы ионных кристаллов обладают электропроводностью;
· многие растворимы в воде; при растворении в воде диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Металлическая решетка

Характерна для веществ с металлической связью. Реализуется в простых веществах — металлах и их сплавах. В узлах решетки — атомы и катионы металла, при этом электроны металла обобществляются и образуют так называемый электронный газ, который движется между узлами решетки, обеспечивая ее устойчивость. Именно свободно перемещающимися электронами и обусловлены свойства веществ с металлической решеткой:
· тепло- и электропроводность;
· обладают металлическим блеском;
· высокие температуры плавления.
Атомная решетка

В узлах решетки — атомы, связанные ковалентными связями. Химическая связь — ковалентная полярная или неполярная. Атомная кристаллическая решетка характерна для углерода (алмаз, графит), бора, кремния, германия, оксида кремния SiO2(кремнезем, кварц, речной песок), карбида кремния SiC (карборунд), нитрида бора BN.
Свойства веществ с атомной решеткой :
· высокие температуры плавления;
Молекулярная решетка

В узлах — молекулы веществ, которые удерживаются в решетке с помощью слабых межмолекулярных сил.
Молекулярное строение имеют:
o все органические вещества (кроме солей);
o вещества — газы и жидкости;
o легкоплавкие и летучие твердые вещества, в молекулах которых ковалентные связи (полярные и неполярные).
Подобные вещества часто имеют запах.
Кристаллические решетки, вид связи и свойства веществ
Т ип решетки
Виды частиц в узлах решетки
Вид связи между частицами
Примеры веществ
Физические свойства веществ
Ионная связь — прочная
Соли, галогениды (IA,IIA), оксиды и гидроксиды щелочных и щел.-зем. металлов
Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток
1. Ковалентная неполярная — очень прочная
2. Ковалентная полярная связь — очень прочная
Простые вещества: алмаз (C), графит (C), бор (B), кремний (Si)
Сложные вещества: оксид алюминия (Al2O3), оксид кремния (IV) SiO2
Очень твердые, очень тугоплавкие, прочные, нелетучие, нерастворимы в воде
Между молекулами — слабые силы межмолекулярного притяжения, внутри молекул — прочная ковалентная связь
При обычных условиях — газы, жидкости или летучие твердые вещества:
Непрочные, летучие, легкоплавкие, способны к возгонке, имеют небольшую твердость
Металлическая связь — разной прочности
Металлы и сплавы
Ковкие, обладают блеском, пластичностью, тепло- и электропроводны
Кристаллическое строение металлов
Металлы — один из самых распространенных веществ в материальной культуре человека. Тысячелетиями медь, железо, серебро и золото были основным материалом для производства оружия, инструментов, ответственных частей транспорта и механизмов, деталей домашней утвари и украшений. В XIX веке, с освоением технологии получения чугуна, металлы пришли в строительство и станкостроение. XX век был веком металлов.

В нашу жизнь вошли алюминий, титан, бор и многие более редкие металлы. Используя их, человечество шагнуло в небо, космос и глубины океана. Металлы сделали возможным массовое производство домашней бытовой техники. В конце XX века пластмассы и композитные вещества ощутимо потеснили металлы с лидирующих позиций. Основные характеристики металлов — прочность, упругость и пластичность определяются их физико-химическими свойствами и атомным строением.
Основные группы металлов в промышленности
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.

Черные металлы покрывают до 90% мировой потребности в металлоизделиях.
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.

Легкие цветные металлы
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.
На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.

Классификация металлов по химическому составу
Химические свойства чистых элементов определяются строением атомов реальных металлов и прежде всего их атомным числом, характеризующим их способность реагировать с водородом, кислородом и другими элементами. Химические характеристики реально применяемых металлов могут сильно отличаться от параметров чистого вещества как в лучшую, так и в худшую сторону.
Нежелательные добавки называют примесями, а те, что вносятся преднамеренно для изменения параметров в нужную сторону — легирующими присадками.
Общепризнанной является классификация, основанная на указании главного компонента сплава.
Атомно — кристаллическое строение металлов
Внутреннее строение металлов и их характеристики определяют их физико-химические свойства. Электроны на внешних орбитах атомов слабо связаны с ядром и имеют отрицательный заряд. При наличии разницы потенциалов электроны мигрируют к положительному полюсу, создавая электрический ток. Это физическое явление обуславливает электропроводность.
Кристаллическое строение свойственно металлам и их сплавам в твердом фазовом состоянии. Атомы выстраиваются в определенную объемную структуру, называемую кристаллической решеткой.
Число атомов в вершинах и на гранях этой структуры, а также дистанция между ними определяют такие физические свойства металла, как электро- и теплопроводность, вязкость, текучесть и т.д.
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция одинакова по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, и его физические параметры меняются в зависимости от направления.

Атомно-кристаллическое строение металлов
В реальном куске металлов, составленному из множества изолированных кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. В среднем свойства такого куска близки к изотропным.
При выстраивании кристаллической решетки некоторые атомы не попадают на свое место, смещаются или теряются. В этом случае говорят о дефектах кристаллического строения металлов. Дефекты структуры отрицательно влияют на свойства изделия, особенно если оно должно быть монокристаллом, как, например, в электронике, лазерной технике и других отраслях высоких технологий.
Физические свойства металлов
Физические свойства определяются внутренним строением металлов.
Главное отличие металлов от других элементов — это их электропроводность и магнитные свойства.
И хотя ученые создали неметаллические материалы, обладающие другим строением, но такими же свойствами, как у металлов и сплавов, они еще слишком дороги для массового применения. Многие химически чистые металлы обладают недостаточной прочностью для практических применений, чтобы исправить ситуацию, в технике и строительстве используют их сплавы.

Физические свойства металлов
Добавление тех или иных присадок приводит к росту прочность получаемого вещества в десятки раз по отношению к исходному элементу.
Электронное строение металлов и их особенности
Внутреннее строение реальных металлов определяет их физико-химические параметры.
Кристаллическая решетка металлов
Все металлы в твердом фазовом состоянии имеют кристаллическое строение. Это пространственное образование из многократно повторяющихся первичных структур называют кристаллической решеткой.
схема кристаллической решетки.

Кристаллическое строение металлов
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция равна по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, его параметры зависят от направления.
В реальном куске металлов, который состоит из множества кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. Усредненные параметры такого куска близки к изотропным.
Типы кристаллических решеток
Дистанцию соседними атомами называют параметром решетки, у разных металлов он составляет 2 — 6 ангстрем. Существуют три основных типа кристаллических решеток:
- Кубическая: объемно-центрированная — включает в себя девять атомов. Свойственна железу, хрому, молибдену, и ванадию.
- Кубическая гранецентрированная: включает в себя уже 14 атомов. Присуща меди, золоту, свинцу, алюминию.
- Гексагональная: атомов уже 17 и размещены они наиболее плотно. Так кристаллизуются магний, цинк кадмий и другие.
Уникальная возможность железа заключается в том, что до 910°С оно имеет кубическую объемно-центрированную структуру, а при нагреве свыше этой температуры переходит к гранецентрированной.
Кристаллическое строение сплавов
Сплав это материал, состоящий из двух и более химических элементов. В его состав могут входить как металлы, так и неметаллы. Например, бронза — это сплав меди и олова, а чугун — сплав железа и углерода. Кроме основных, в состав могут входить и другие вещества, содержащиеся в небольших количествах. Если их добавляют специально и улучшают свойства материала, их называют легирующими присадками, если ухудшают — вредными примесями.
Кристаллическое строение сплавов сложнее, чем металлов.

Оно определяется взаимовлиянием компонентов при образовании кристалла, и принадлежит к трем подвидам:
- Твердые растворы. Один элемент растворяется в другом. Ведущий элемент строит кристаллическую структуру, а атомы второстепенного элемента размещаются в объеме этой решетки.
- Химическое соединение. Элементы химически реагируют друг с другом, образуя новое соединение. Из его молекул и составляется кристаллическая решетка.
- Механическая смесь. Элементы сплава не реагируют друг с другом. Каждый строит свои кристаллические структуры, срастающиеся в независимые кристаллы. Сплав будет представлять собой затвердевшую смесь из множества кристалликов двух разных типов. Такое вещество будет иметь собственную температуру перехода в жидкую фазу.
Физические свойства сплавов могут заметно меняться при изменении процентного соотношения составляющих.
Кристаллизация сплавов
Первичная кристаллизация — это затвердевание расплава с образованием кристаллических решеток. Пространственные атомные и молекулярные структуры, возникающие в ходе такого процесса, оказывают решающее влияние на свойства получаемого сплава.
Сначала в остывающем расплаве возникают центры кристаллизации, вокруг них в ходе процесса и нарастают кристаллы, многократно повторяя структуру центра. В качестве центров кристаллизации могут выступать:
- Первые образовавшиеся кристаллы в зонах локального охлаждения, чаще всего у стенок литейной формы.
- Частички неметаллических примесей.
- Тугоплавкие примеси, уже находящиеся в твердой форме.

Процесс кристаллизации металлов и сплавов
Кристаллы обычно растут в направлении роста градиента температуры. Если рост решеток не встречает физических препятствий, образуются ветвящиеся кристаллические структуры, напоминающие кораллы — дендриты. Если они растут из разных центров и встречаются в расплаве, то препятствуют росту друг друга и искажают свою форму. Такие искаженные кристаллы – это кристаллиты, или зерна. Совокупность отдельных зерен срастается в поликристаллическое тело.
Отдельные кристаллиты достигают размеров от одного до 10 000 микрон и по-разному развернуты в пространстве. На стыках отдельных кристаллитов образуется граничный слой, в котором кристаллические решетки разорваны. Такие слои обладают измененными химическими и физическими свойствами.
Решетки кристаллитов могут обладать разными дефектами структуры:
- точечные;
- линейные;
- поверхностные;

Дефекты кристаллического строения металлов
Дефекты определяются отсутствием атома или группы атомов в вершинах или гранях кристаллической решетки, смещением этих атомов со своих мест или замещением атома или их группы атомами или молекулами примесей.